异基因CAR-T治疗血液肿瘤的新进展
时间:2024-09-16 23:00:48 热度:37.1℃ 作者:网络
CAR-T细胞疗法是治疗血液系统恶性肿瘤的有效方法。自2017年以来已有多种自体CAR-T细胞(auto-CAR-T)药物获批用于治疗某些类型的复发/难治性血液系统恶性肿瘤。然而由于制造时间长、批次差异大、原代T细胞质量差、数量不足、扩增和功能不足等原因,部分患者(10–20%)对这些药物没有反应。从异基因来源制备的CAR-T细胞(allo-CAR-T)可能是克服这些障碍的另一种选择,目前已有部分allo-CAR-T进入早期临床试验。尽管它们的临床前和临床数据很有希望,但也存在两个主要障碍,包括移植物抗宿主病(GvHD)和异体排斥反应,可能会降低allo-CAR-T在临床中的安全性和有效性。此外,这些产品的成功开发还取决于启动细胞来源、基因编辑方法以及逃避免疫排斥和预防GvHD。
《Cancer Cell International》近日发表综述,总结了基因编辑技术和各种细胞来源在开发allo-CAR-T的潜力,并强调了它们在治疗血液恶性肿瘤方面的优势;还描述了针对血液恶性肿瘤的allo-CAR-T治疗的临床前和临床数据,并讨论了其应用的挑战和未来前景。

异基因CAR-T细胞
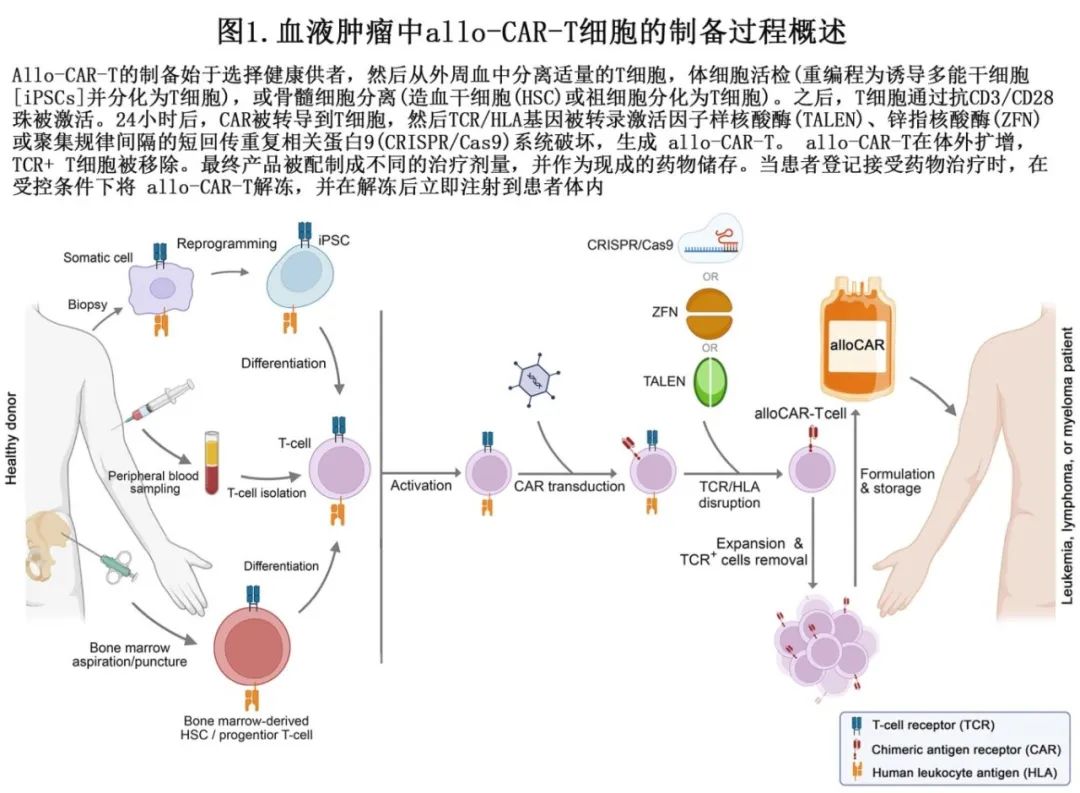
与auto-CAR-T有所不同,allo-CAR-T是从健康供者的外周血单核细胞(PBMC)中培养的,其中包括T淋巴细胞和B淋巴细胞;然后用单采法分离原代T细胞。T细胞分为αβ T细胞和γδ T细胞两类,它们表面分别表达TCR-α链和TCR-β链,或TCR-γ链和TCR-δ链,并作为区分。在所有循环中的T细胞中,95%为αβ T细胞,其余5%为γδ T细胞。与γδ T细胞不同,αβ T细胞仅在HLA背景下通过TCR识别抗原,因此αβ T细胞容易引起移植物抗宿主病(GVHD),后者依赖于HLA。因此,为避免异基因T细胞植入造成的不良反应,如重度GvHD,必须在体外敲除原代T细胞,以获得TCR等反应性抗原。当allo-CAR-T通过TCR识别宿主的正常组织攻击宿主组织时,就会发生GvHD。此外,allo-CAR-T既可以克服自相残杀(fratricide)等抵抗机制,也可以预防宿主免疫系统攻击allo-CAR-T(由于针对 HLA 不匹配移植物的受体抗 allo-CAR-T 应答)导致的异基因排斥风险。HLA复合物(β2-微球蛋白(β2m)结构域)和TRAC (T细胞受体α常数)或TRBC (T细胞受体β常数)结构域的破坏可分别消除异基因排斥反应和GvHD。
已有不同的基因编辑工具应用于原代T细胞,使研究人员能够特异性地敲除潜在的异基因反应性抗原,并在特定位点敲入所需的基因(例如CAR)或招募多重编辑来提高T细胞的抗肿瘤靶向性和活性。在allo-CAR-T制备中,插入CAR(通常通过转导)或删除反应性抗原的优先级会影响基因编辑的效率。CAR先转导后缺失HLA和TCR抗原具有基因编辑效率更高、CAR-T细胞活力更高等优势。
不同治疗剂量的allo-CAR-T细胞可以储存作为任何患者的 “现货”治疗。allo-CAR-T制备工艺概述如图1所示。虽然大多数allo-CAR-T的细胞来源为原代T细胞群,但其他来源也已显示出合适的潜力,包括诱导的多能干细胞(iPSC)、脐带血(作为iPSC来源)和祖细胞。
allo-CAR-T产品的替代细胞来源
尽管原代 T 细胞是应用于 CAR-T 细胞治疗中最传统的细胞,但这些原代成熟细胞的基因操作极具挑战性,因其应该被修饰用于同时操纵 CAR 表达和 HLA 缺陷。外周血细胞单采和骨髓穿刺是实现 T 细胞高计数的两种标准方法。同时,不同类型的 T 细胞(即αβT细胞和γδT细胞)能够生成allo-CAR-T。γδT细胞是效应 T 细胞的一个亚群,具有较高的溶细胞活性。尽管αβT细胞通过αβTCR识别宿主细胞的 HLA 呈递抗原,但γδT细胞含有γδTCR,可独立于 HLA 呈递识别靶抗原。因此γδT细胞可以成为生成 allo-CAR-T 的合适来源,而不会引起GvHD。应用γδT细胞生成 allo-CAR-T 面临的一个主要挑战在于,其在 PBMC 中的低计数(小于10%)。使用γδT细胞作为 allo-CAR-T 来源的一个例子为glypican-3(GPC-3) 特异性allo-CAR-T,开发用于消除肝细胞癌细胞。GPC-3 特异性 allo-CAR-T单次给药可有效控制肿瘤生长,无任何 GvHD。
iPSC是再生医学中很有前途的细胞,其具有通过重编程到胚胎状态(多能性)向各种细胞系分化的潜力。在自体方式下,iPSC作为CAR免疫细胞的潜在来源,可分化为来自受者体细胞的各种肿瘤免疫监视相关细胞。对于CAR免疫细胞的产生,与捐献的T细胞相比,iPSC可以自我更新并大大扩展。储存在细胞库中的HLA定义的iPSC是HLA相合的CAR免疫细胞异基因移植的良好来源,但以完全异基因的方式。此外,缺乏HLA的iPSC是有希望的来源,可用于产生缺乏HLA的iPSC衍生的allo-CAR-T。异基因iPSC衍生CAR-T细胞的优点包括细胞来源更容易获得、基因工程更直接、最终产品的可扩展性更高。尽管iPSC有很多好处,但它容易形成畸胎瘤,从而限制了iPSC衍生细胞产品的临床应用;然而各种研究已经建立了消除这些产品中畸胎瘤形成的通路。尽管iPSC技术取得了较大进步,但也存在伦理问题,即干细胞的衍生、致瘤性的潜力以及有关干细胞治疗的总体伦理问题。欧洲胚胎干细胞注册中心(hESCreg)登记了iPSC在治疗中的应用,例如iPSC的来源(供者iPSC表型,细胞系产生/分配),知情同意文件,法规遵从性(iPSC的基因分型,标记表达和功能多能性),以及一些特定的限制(例如基因修饰控制和亚克隆)。此外,一些针对iPSC的良好生产工艺(GMP)细胞库也被开发出来,可用于生成allo-CAR-T。
移植异基因造血干细胞(alloHSC)是白血病的一种很有前途的治疗方法。此外,造血干细胞可分化为T谱系以产生allo-CAR-T。作为CAR-T细胞治疗的强化治疗程序,在移植CAR-T细胞之前,患者应接受清淋方案,以避免GvHD,其可因HSC的丢失而导致发育不全(aplastic)状态。因此在CAR-T细胞植入后,需要移植造血干细胞来实现稳态造血。因此,异基因造血干细胞的产生使我们能够为造血干细胞移植产生安全的细胞产物,同时也为allo-CAR-T提供合适的来源。尽管造血干细胞作为allo-CAR-T的来源具有临床获益,但其制备仍面临挑战。例如,造血干细胞在骨髓和外周血中罕见,特别是在白血病患者中。此外,iPSC和HSC作为有效的干细胞来源,应考虑维持干细胞的干性、细胞活力和功能,避免不希望的分化、基因稳定性和allo-CAR-T的GMP安全性。
淋系祖细胞是allo-CAR免疫细胞的另一个有希望的来源。人淋系祖细胞系是一种具有向T细胞分化能力的单能干细胞,与T/NK细胞源相比,其自我更新能力使衍生的CAR-T细胞具有更高的扩增率。CAR在人淋系祖细胞中的表达可以使它们分化为具有高细胞毒性的T细胞和NK细胞。淋系祖细胞存在于脐带血和骨髓中。
allo-CAR-T治疗血液肿瘤的优势
除了allo-CAR-T的一般获益外,与auto-CAR-T相比,它们在治疗血液恶性肿瘤方面还有多个优势。与auto-CAR-T相比,allo-CAR-T在急性淋巴细胞白血病(ALL)患者中显示出较轻的细胞因子释放综合征(CRS)和相似的疗效。allo-CAR-T的另一个显著优势在于消除了桥接治疗(单采和输注之间的治疗,用于控制肿瘤负荷),桥接治疗需要额外的治疗费用,如果患者对以前的药物产生耐药性,其疗效也会受到限制。然而患者可以在入组后5天内成功接受allo-CAR-T而无需桥接治疗。因此,allo-CAR-T还可以降低住院和干预的费用。
allo-CAR-T可消除CAR基因在制备过程中转移到血液肿瘤细胞的风险。B-ALL是一种侵袭性血液肿瘤,患者的血液和骨髓中淋巴细胞过度生长。一份病例报告显示,尽管在使用Tisagenlecleucel治疗B-ALL前进行了清淋,但单个白血病细胞无意中污染了从患者身上分离出来的淋巴细胞,并在auto-CAR-T制备过程中被CD19CAR转导,结果由于CD19表位被掩蔽而导致肿瘤耐药、疾病复发和进展性白血病导致死亡。虽然到目前为止还没有其他病例报道,但在不同血液肿瘤患者的CAR-T制备过程中,肿瘤细胞无意转导的潜在风险仍令人担忧,而使用健康供者的细胞来源可以解决CAR转导到肿瘤细胞的问题。此外,与R/R弥漫性大B细胞淋巴瘤(DLBCL)等血液肿瘤患者相比,健康供者血液中不需要的循环细胞(如MDSC)的数量较少,从而可能提高T细胞的转导率并增加制备成功率。
allo-CAR-T治疗血液肿瘤的临床结局
由于临床前研究结果较好,目前有多种allo-CAR-T应用于骨髓瘤、淋巴瘤和白血病的临床试验,共达近百项试验,其中CD19、CD20、CD22、BCMA、CD7和CD123是最常见的靶抗原。此外,TALEN和CRISPR/Cas9是临床级allo-CAR-T中使用的最安全的平台。在各种正在进行的allo-CAR-T细胞治疗血液肿瘤的临床试验中,只有两项完成I期临床试验,即应用“UCART19”通用CD19 CAR-T细胞(NCT02746952和NCT02808442)和“ALLO-715”通用BCMA CAR-T细胞。
在UCART19的研究中,异基因CD19 CAR-T细胞来源于健康供者,在所有患者接受抗CD52治疗的同时,通过TALEN同时破坏TCRαβ和CD52。本研究分为两项试验:(i) 7例6个月至18岁的儿科ALL患者(NCT02808442), (ii) 14例18至70岁的成人ALL患者(NCT02746952)。儿科ALL患者接受1.1-2.3 ×106细胞/kg的剂量,而成人ALL患者接受逐步递增的剂量(6×106、6-8×107和1.8-2.4×108细胞/kg)以确定最大耐受剂量。此外,患者在试验开始前接受环磷酰胺、alemtuzumab和氟达拉滨清淋。在输注后14天左右,UCART19达到最大扩增。NCT02746952的总缓解率(ORR)为48%,总生存期为13.4个月。此外,分别有24%和4%的患者报告了CRS(≥3级)和神经毒性。
使用UCART19治疗可导致与自体CD19 CAR-T细胞相关的不良反应。在21例接受治疗的患者中,91%的患者出现CRS,62%的患者出现感染,38%的患者出现神经毒性。32%的患者出现与强化清淋的骨髓抑制作用相关的长期血细胞减少。2例患者病理证实皮肤1级急性GvHD。异基因干细胞移植后,4例患者出现GvHD(最高3级)。2例B细胞ALL复发的婴儿也应用了UCART19,均达到CR, 5年无病生存。总的来说,与自体CAR-T细胞相比,UCART19通常是一种“安全”的现成CAR-T细胞产品。
另一项已完成的allo-CAR-T研究为ALLO-715治疗MM患者,使用320×106 ALLO-715细胞治疗BCMA+ MM细胞,清淋方案为alemtuzumab、氟达拉滨和环磷酰胺。结果25%的患者完全缓解,45.8%的患者部分缓解。CRS和神经毒性分别占55.8%和14%。这些临床试验的结果表明,allo-CAR-T治疗R/R血液肿瘤具有有很好的疗效。
allo-CAR-T同样可发生CRS和神经毒性。但总的来说,与传统的CAR-T细胞疗法相比,allo-CAR-T在血液系统恶性肿瘤的临床治疗中显示出显著的结果,没有额外的不良反应。当然也并非没有挑战。尽管allo-CAR-T的TCR消融,但不同的临床数据显示GvHD的发生率也有所不同。例如,虽然TCR破坏的allo-CAR-T治疗RRMM没有显示出GvHD的副作用,但TCR破坏的allo-CAR-T治疗R/R白血病的GvHD等级为1级或2级。使用来自UCB的T细胞代替成人血液T细胞可以降低GvHD的频率和强度。实际上,UCB细胞在初次抗原刺激后,由于Th1/Th2细胞因子谱降低以及NFAT通路的激活降低,从而导致几种促炎细胞因子的产生降低,从而具有较低的反应性。此外,使用其他非αβ细胞来源,如粘膜相关不变T (MAIT)细胞、NK细胞或γδ T细胞也可能消除GvHD的风险。
另一方面,尽管使用氟达拉滨和环磷酰胺进行清淋,但allo-CAR-T治疗对部分白血病患者无效,因为allo-CAR-T无法扩增,没有抗肿瘤活性,可能是由于工程淋巴细胞的异体排斥反应,因为只有在给予额外的淋清淋剂(如抗CD52抗体)时,患者才表现出抗肿瘤反应和体内扩增。事实上,除了敲除TCR外,这些allo-CAR-T设计为破坏CD52位点,CD52位点在淋巴细胞表面表达,通过alemtuzumab清淋不影响allo-CAR-T。也可以通过基于抗体的选择来帮助消除未修饰的CAR-T细胞。因此,在输注allo-CAR-T的同时,抗CD52抗体的施用也可以控制异基因排斥反应,并可能增强allo-CAR-T的持久性和有效性。然而,由于阻断宿主的T细胞反应,患者面临严重败血症和血细胞减少症的风险可能增加。临床前数据显示,表达抗41bb受体(称为同种免疫防御受体(ADR))的allo-CAR-T可以通过选择性消除宿主活化的淋巴细胞(包括T细胞和NK细胞)来克服异基因排斥反应,同时维持静止的T细胞和NK细胞。
总结
allo-CAR-T细胞可以解决CAR-T的一些局限性。更少的制造时间(节省6周以上的时间)、更合适的细胞来源、升级改造简单、GMP背景下的制备过程标准化,以及储存不同治疗剂量的allo-CAR-T使其成为比auto-CAR-T更具成本效益。此外,allo-CAR-T可消除桥接治疗和消除CAR-T细胞不小心污染肿瘤细胞的风险。基因编辑或基于细胞的策略可以解决GvHD和异基因排斥并发症。包括TALEN、CRISPR/Cas和ZFN在内的基因编辑方法用于删除传统原代T细胞和其他细胞类型中的免疫反应性标记,如TCR α/β和β2M位点。然而,HLA缺陷T细胞仍可以通过宿主NK细胞的靶向而发生异基因排斥反应。在异基因T细胞中,除了删除HLA区域外,表达NK细胞抑制剂(如HLA- e)也可以克服这一问题。临床前研究表明,HLA 1类、2类和TCR的多重破坏,以及CAR的插入,可以增强allo-CAR-T的抗肿瘤疗效和安全性。此外,如果在使用抗CD52抗体清淋的同时使用allo-CAR-T治疗,那么在allo-CAR-T中删除CD52可以防止异基因排斥反应。然而,由清淋引起的学细胞减少症在可能是临床不良事件。在基于细胞的策略中,γδ T细胞(例如Vδ1 γδ T细胞)、T细胞衍生的诱导多能干细胞、淋系祖细胞和供者衍生的EBV靶向T细胞可以作为制造allo-CAR-T的原料,而无需通过基因编辑来消除GvHD或异基因排斥反应。
大多数临床试验中的allo-CAR-T都是用于血液系统恶性肿瘤,可能是由于实体瘤中缺乏肿瘤特异性抗原和由此产生的脱靶毒性,以及血液系统恶性肿瘤的复杂性较低,包括患者中循环MDSC或调节性T细胞等抑制细胞较少。另一方面,尽管CRISPR/Cas系统设计更简单,但大多数临床试验应用TALEN工具来设计T细胞以用于异基因。造成这种情况的一个主要潜在原因可能是在几项研究中观察到的CRISPR/ Cas技术的脱靶和易位风险。CRISPR/Cas系统的新设计可以提高其在allo-CAR-T制造中的应用安全性。
尽管allo-CAR-T在血液系统恶性肿瘤患者中的抗肿瘤疗效和安全性与auto-CAR-T相似,但在实体肿瘤中还需要更多的研究。对allo-CAR-T进行多重基因编辑的可能性使它们成为对不同癌症具有高治疗潜力的良好候选者。
参考文献
Mansoori, S., Noei, A., Maali, A. et al. Recent updates on allogeneic CAR-T cells in hematological malignancies. Cancer Cell Int 24, 304 (2024). https://doi.org/10.1186/s12935-024-03479-y


