JITC:殷咏梅教授团队发现沙坦类降压药竟能逆转冷肿瘤屏障
时间:2024-09-22 11:00:14 热度:37.1℃ 作者:网络
作为一种新兴的癌症治疗方法,免疫检查点阻断(ICB)取得了显著成就,但并非所有晚期肿瘤患者都对ICB治疗有反应。因此,在接受ICB治疗前应筛选出潜在的受益人群。肿瘤微环境(TME)是一个复杂的系统,主要由免疫细胞、基质细胞和细胞外基质(ECM)分子组成,影响着癌症的多个标志性特征。TME对肿瘤进展有重要影响,因此重塑TME已成为促进癌症治疗发展的策略。免疫细胞和胶原蛋白作为其中最显著的细胞成分和分子,极大地影响了抗肿瘤免疫。胶原蛋白由癌症相关成纤维细胞(CAF)合成,而胶原蛋白沉积是阻碍免疫细胞渗透的最重要物理因素。在之前的研究中,我们开发了一种泛癌免疫-胶原亚型分层策略,根据胶原蛋白沉积和免疫活性对患者进行分层,并识别出一种被称为装甲冷肿瘤的耐药性癌症亚型,该亚型伴随高胶原活性和低免疫浸润。因此,目前尚无有效的抗肿瘤疗法可用于装甲冷肿瘤。
近日,南京医科大学殷咏梅、朱一超、丁军利等人与国内研究者合作,在Journal for ImmunoTherapy of Cancer期刊发表的研究成果显示,ARB类降压药竟然可能是“装甲冷肿瘤”助攻剂,即它们能够专门针对免疫浸润极差、且微环境中堆积大量胶原的难治性冷肿瘤,成功逆转肿瘤微环境的免疫抑制性,为免疫检查点抑制剂(ICB)起效创造有利条件。
但是,如何发现能解除“装甲冷肿瘤”魔咒呢?研究者从临床合并用药角度入手。有研究报告显示高达84%的患者存在多药使用,并且也有一些研究发现合并用药与ICB存在潜在相互作用。有研究发现,接受免疫治疗的患者如果同时服用质子泵抑制剂、抗生素或类固醇,临床收益较少,这表明合并用药对ICB疗效有显著影响。在我们之前的报告中,我们揭示了胆固醇合成在非小细胞肺癌(NSCLC)中的重要性,并证明了ICB与他汀类药物联合使用能提高治疗效果。此次在此基础上,进一步筛选。
AGTR1在装甲冷肿瘤中高表达
首先,基于我们建立的免疫-胶原亚型分层策略,我们系统性地筛选了在装甲冷肿瘤中差异表达的合并用药潜在靶点,并发现血管紧张素II受体1型(AGTR1)在装甲冷肿瘤中高表达。血管紧张素Ⅱ 1型受体(AGTR1)仅在很少一部分实体瘤中高表达,但这些肿瘤偏偏都是免疫治疗最难攻破的堡垒,且AGTR1仅在这类肿瘤微环境中的肿瘤相关成纤维细胞(CAFs)内高表达,ARB类降压药则会通过结合AGTR,抑制CAFs的RhoA-YAP信号轴来减少I型胶原蛋白表达,由此逆转微环境免疫抑制。
而不管是在外部数据库资料(TCGA膀胱癌队列),还是在研究者们筛选的本院乳腺癌、膀胱癌患者队列中,ARTG1的高表达均与患者生存预后不佳和肿瘤免疫浸润差(CD8低表达)、免疫治疗效果差相关,且ARTG1的高表达基本仅限于CAFs;使用ARBs的代表性药物氯沙坦处理,对ARTG1低表达的肿瘤也不痛不痒,只有ARTG1高表达肿瘤才会被重创。
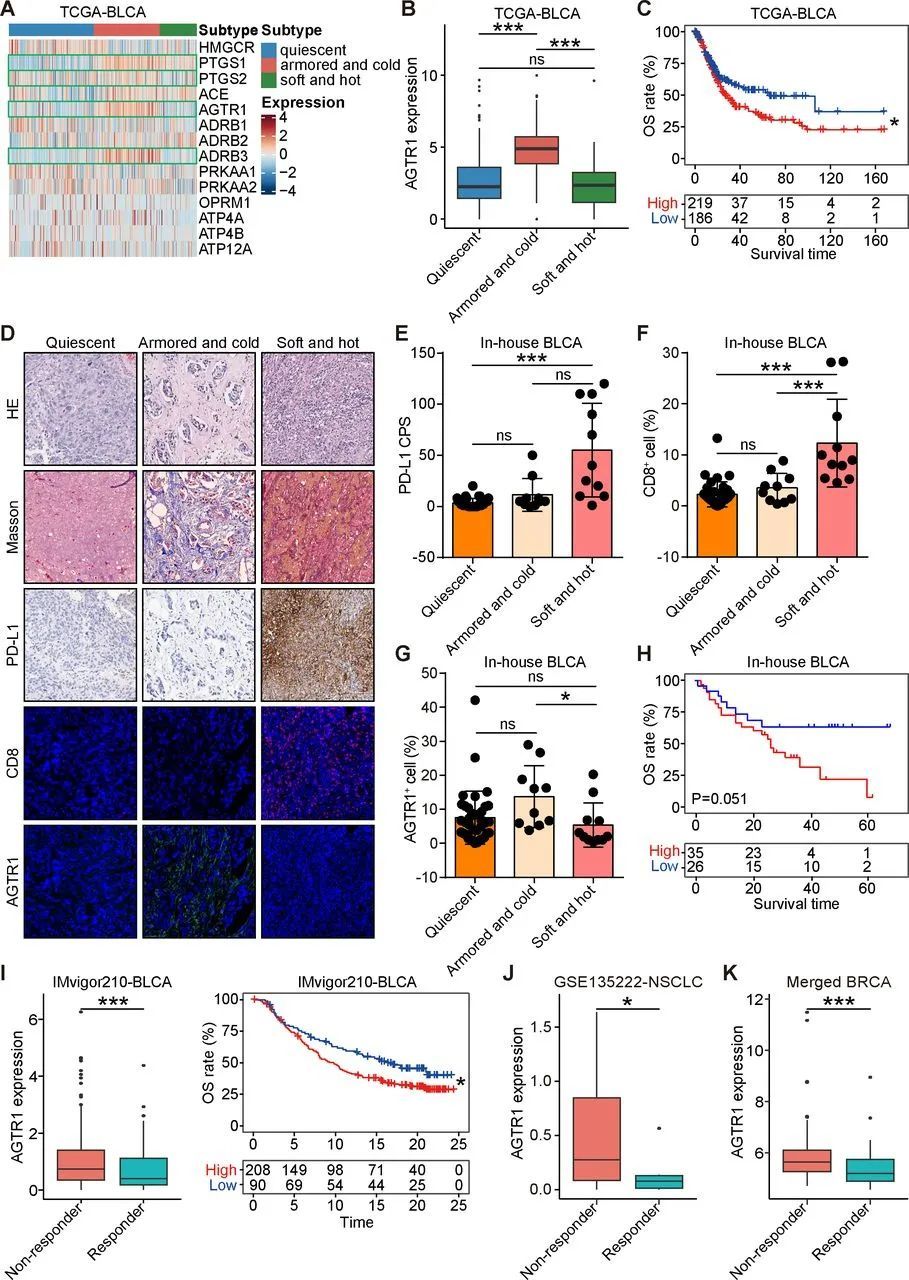
ARTG1的高表达基本仅限于“装甲冷肿瘤”,且能预测患者生存预后和免疫治疗效果
但是,由于 AGTR1 表达水平较低,ARB 对大多数肿瘤细胞没有抗肿瘤作用。但是,ARTG1的高表达基本仅限于“装甲冷肿瘤”。因此,这可能是ARB类应用的潜力。
进一步研究发现,ARB 通过抑制 RhoA-YAP 轴来抑制胶原蛋白表达和 CAF 迁移。采用氯沙坦处理来看,ARBs的作用对象应该主要就是肿瘤微环境内的CAFs,而它们最常被提及的职能不就是合成胶原吗?研究者们进行的GO-BP分析显示,CAFs的AGTR1表达水平与胶原合成、细胞迁移关键基因表达特征,以及细胞外基质形成均显著相关,而氯沙坦则通过抑制RhoA-YAP轴,显著降低了CAFs合成I型胶原蛋白及迁移的能力。
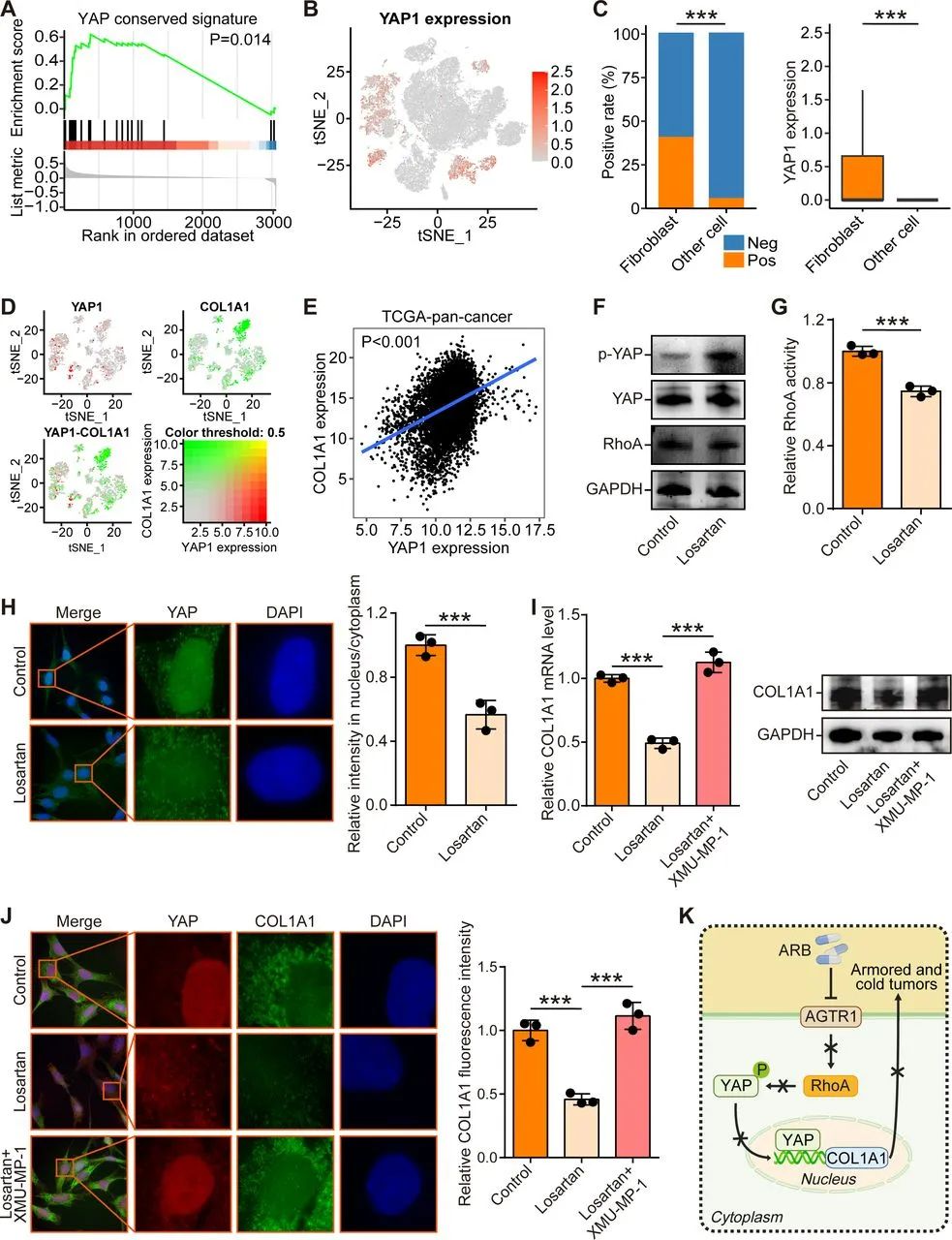
ARBs可通过抑制RhoA-YAP轴显著减少CAFs合成的I型胶原
减少I型胶原,意味着减少细胞外基质,从而破除肿瘤用来抵抗免疫浸润的关键物理屏障。共培养实验显示,经氯沙坦处理后的CAFs与CD8+T细胞共培养时,各种激活标志物相比对照组(CAFs未经氯沙坦处理)都显著上调,而抑制性标志物下调,看来CD8+T细胞们活性也提升。
小鼠实验也证实,将10mg/kg剂量的氯沙坦(不会显著降低血压)与PD-1抑制剂联合使用,能够显著改善免疫治疗的效果,且肿瘤内胶原堆积明显减少,说明氯沙坦达成了逆转免疫微环境抑制性的目标;
ARB 塑造TME 并增强抗 PD-1 免疫治疗反应
胶原沉积是阻碍免疫细胞浸润的最重要物理因素,因此我们怀疑抑制 AGTR1 可能会逆转胶原介导的免疫逃逸。根据我们 scRNA-seq 数据集中 CAFs 中 AGTR1+ 细胞的百分比,我们以 10% 为标准将患者分为 AGTR1 阳性组和 AGTR1 阴性组(图 5A)。接下来,我们在单细胞水平上评估了 CD8+ T 细胞的功能状态。结果表明,在 AGTR1 阳性癌症样本中,CD8+ T 细胞的耗竭水平升高,但 CD8+ T 细胞的细胞毒活性降低(图 5B)。然后,将 T 细胞与有或没有氯沙坦的 CAFs 共培养(图 5C),并通过 PCR 阵列检查 T 细胞的活性水平。结果表明,在氯沙坦治疗下与 CAFs 共培养的 T 细胞中,大多数活化标志物上调,抑制标志物下调(图 5D、E)。此外,还用流式细胞术检查了T细胞中的GZMB水平,结果显示,在用氯沙坦处理的CAFs共培养的T细胞中,GZMB高表达(在线补充图S9A,B)。此外,在氯沙坦处理的共培养培养基中,激活炎症因子(包括IL-2和TNF-α)的水平也高表达(图5F)。这些结果表明氯沙坦显著抑制了CAF介导的T细胞抑制。此外,来自临床样本的证据还显示,AGTR1 +细胞的数量与CD8 +细胞的数量呈负相关(图5G,在线补充图S10A-C)。为了评估氯沙坦在体内的降压作用,我们给Balb/c小鼠分别注射10 mg/kg、20 mg/kg和30 mg/kg氯沙坦1周,结果显示氯沙坦以剂量依赖性方式降低血压,10 mg/kg剂量对血压无显著影响(在线补充图S11)。因此,接下来的体内试验以10 mg/kg剂量进行。氯沙坦在体外不影响4T1肿瘤细胞的增殖(在线补充图S12A,B),但在体内显著抑制肿瘤生长(图5H,I)。此外,氯沙坦介导的肿瘤抑制可以通过CD8缺失逆转(图5H,I),表明氯沙坦的抗肿瘤作用依赖于肿瘤免疫。

此外,我们给携带4T1细胞的Balb/c小鼠施用氯沙坦和/或抗PD-1抗体。接受联合治疗的小鼠的肿瘤体积(图6A)和肿瘤重量(图6B)均显着减小。
ARB 的使用可增强对 ICB 疗法的反应并延长癌症患者的生存期
接下来研究了 ARB 的使用对 NSCLC 临床结果的影响。我们收集了两个内部队列,分别包含 105 名和 165 名接受抗 PD-1/PD-L1 免疫治疗的 NSCLC 患者。我们根据 RECIST V.1.1 标准评估了治疗反应,并获得了生存数据和 HE 染色图像(图 7A)。此外,还获得了来自 5 名 ARB 使用者和 5 名非 ARB 使用者的共 10 个 FFPE 样本(图 7A)。结果表明,ARB 的使用显著改善了两个相关队列中 NSCLC 患者的 OS(图 7B、C)。此外,ARB 使用者的肿瘤样本显示基质标志物(胶原蛋白、α-SMA 和 AGTR1)表达较低,免疫标志物(CD8 和 PD-L1)表达较高(图 7D)。此外,两个内部队列的整合分析支持 ARB 的使用与低纤维化水平和高免疫细胞浸润相关(图 7E)。此外,ARB 的使用显著增强了对免疫治疗的治疗反应,并改善了整合队列中 NSCLC 患者的 OS(图 7F、G)。更重要的是,荟萃分析进一步证实,ARB 的使用与接受免疫治疗的癌症患者的 OS 改善显着相关(图 7H)。总体而言,这些发现表明 ARB 的使用是逆转装甲冷肿瘤并提高对 ICB 治疗反应的辅助策略。
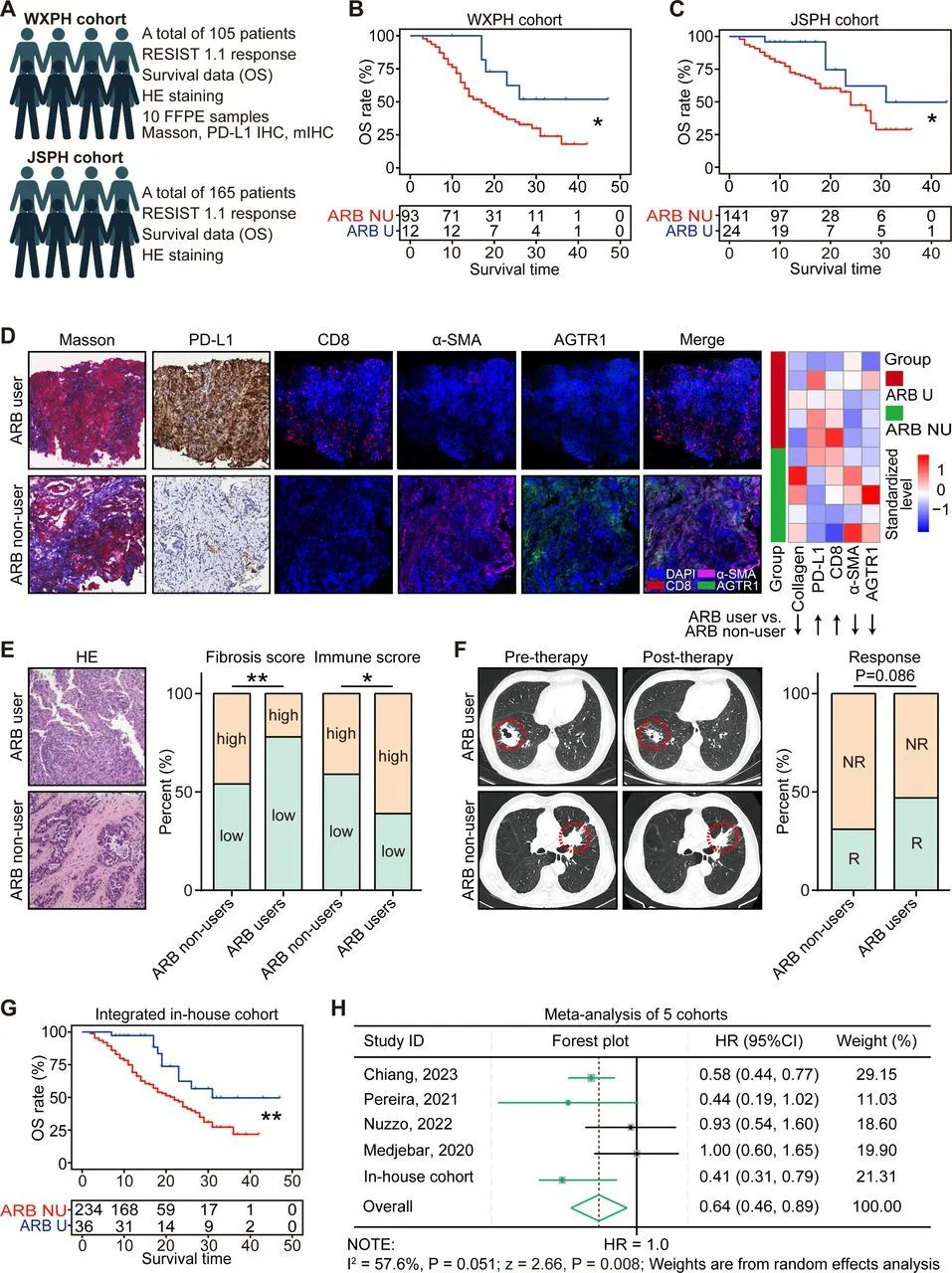
图:在接受免疫治疗期间,同时使用ARBs的肺癌患者生存预后更好
总之,我们根据已确定的免疫胶原亚型系统地筛选了潜在的伴随药物,发现 ARB 是治疗装甲冷肿瘤的有希望的候选药物。ARB 通过负向调节 RhoA/YAP 轴来抑制 CAFs 中的 I 型胶原表达,从而形成发炎的 TME。总体而言,本研究为装甲冷性肿瘤中 ARB 与 ICB 疗法的联合治疗提供了全面的理论依据。

原始出处:
N, Ding J, Zhu Y, Cai Y, Yin Y.Angiotensin receptor blocker attacks armored and cold tumors and boosts immune checkpoint blockade.J Immunother Cancer. 2024 Sep 6;12(9):e009327. doi: 10.1136/jitc-2024-009327


