【期刊导读】综述:HBV感染的机体免疫应答改变
时间:2024-09-13 06:00:41 热度:37.1℃ 作者:网络
编者按
近年来,随着慢乙肝领域研究的深入,对于乙肝相关的免疫学机制已有了初步的了解。近期,Journal of Viral Hepatitis上发表的一篇来自新加坡的综述详细介绍了慢性HBV感染的机体先天免疫和适应性免疫应答的改变。肝霖君整理重点内容与大家分享。

一 HBV感染时先天免疫应答的作用及变化
01 HBV感染无法激活强大的先天免疫应答
HBV无法激活强大的先天免疫应答可能与其缓慢的病毒复制动力学有关。大多数病毒在感染后立即进入繁殖的对数阶段(如HCV、HIV和流感),而HBV在感染后6 - 8周才达到其复制高峰。
HBV对I型干扰素(IFN)和其他促炎细胞因子(如IL-1b、TNFα和IL-6)的抑制作用具有高度敏感性。IFNα作为慢乙肝治疗的常用药物之一,可有效抑制HBV复制,其直接抗病毒作用是通过诱导与HBV cccDNA结合的组蛋白的表观遗传变化及加速具有复制能力的HBV核衣壳的衰减来实现的。高剂量的IFNα也可通过激活APOBEC3A胞苷脱氨酶来诱导cccDNA降解。
02 HBV蛋白可能抑制感染者的HBV特异性免疫
HBV感染时先天免疫被抑制也可能是由于HBV蛋白(HBsAg、HBeAg)的作用(图1A,B),慢性HBV感染的标志之一是持续产生过量的可溶性HBsAg和HBeAg,由此导致的缺陷病毒颗粒的过度产生可能使成熟的病毒粒子逃避抗体识别。
持续暴露于HBV蛋白中会改变髓细胞和浆细胞样树突状细胞的频率和功能,抑制TLR-2表达或干扰TLR介导的细胞因子的产生。
可溶性病毒抗原可通过改变抗原提呈细胞的细胞因子产生能力来抑制其功能,从而阻碍HBV特异性T细胞的活化。
HBV蛋白的过量产生和分泌也可能逐步耐受或消除HBV特异性T和B细胞应答,且优先作用于适应性免疫的HBV特异性组分。HBeAg的垂直传播会改变后代巨噬细胞的功能,并诱导PD-L1上调,从而抑制HBc特异性T细胞的功能(图1A)。髓系来源的抑制性细胞可以将HBsAg携带至胸腺,并在母婴传播后减少HBs特异性CD8+ T细胞的生成(图1B)。
HBV病毒抗原对先天免疫和适应性免疫的影响可能不一定是有害的。一项研究发现与HBsAg阴性新生儿相比,HBsAg阳性新生儿脐带血中髓系细胞的“杀菌能力”更强(图1A)。
综上,虽然HBV可能抑制感染者的HBV特异性免疫(适应性免疫),但在新生儿特别易受细菌感染的最初几个月,它可能会增强免疫系统的整体成熟。
03 NK细胞在慢性HBV感染中发挥重要作用
NK细胞具有识别和杀伤病毒感染细胞的能力。多项研究表明NK细胞参与慢性HBV感染,可能被炎症细胞因子激活并在肝损伤中发挥作用,同时也可被各种免疫调节细胞因子(如IL-10、TGF- β)所抑制(图1E)。
在慢性HBV感染中,NK细胞主要发挥“免疫调节剂”的作用。此外,NK细胞可以选择性溶解血液中表达TRAIL-2死亡受体的、过度激活的HBV特异性CD8+ T细胞(图1C)。
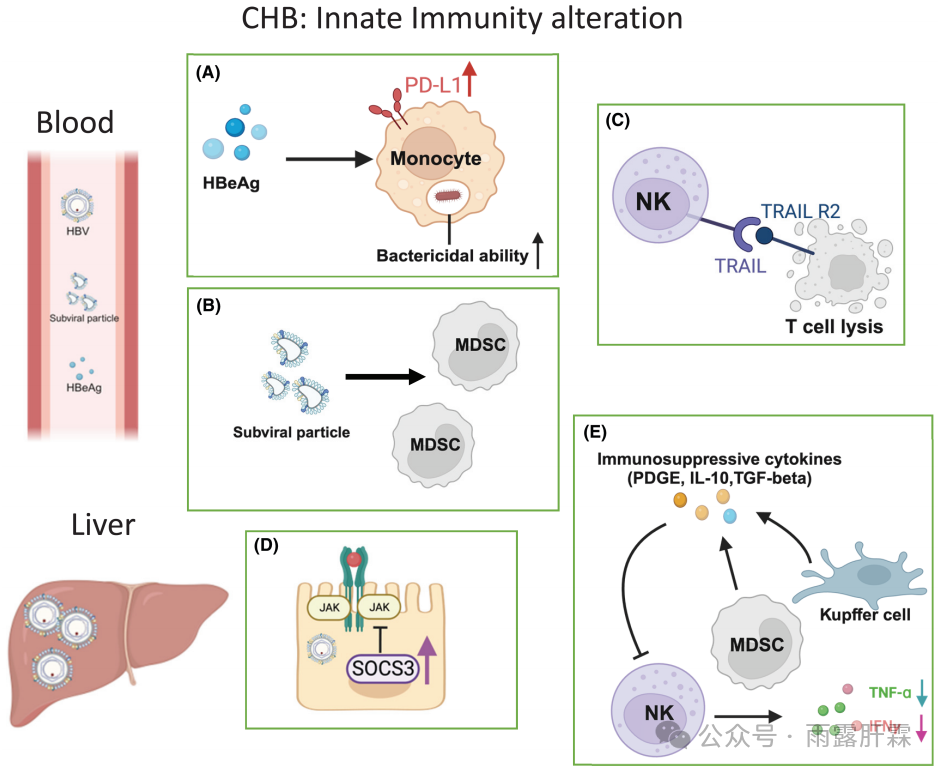
图1. 慢乙肝感染中先天免疫应答的变化
血液:
(A)感染HBV后单核细胞的改变:HBeAg增加PD-L1表达,抑制HBc特异性T细胞;杀菌效果增强;
(B)MDSC捕获HBsAg并可能清除HBsAg特异性T细胞;
(C)活化的NK细胞溶解表达TRAIL的HBV特异性T细胞。
肝脏:
(D)炎症事件触发肝内SOCS3过表达;
(E)MDSC频率增加,髓系细胞过表达PDGE、IL-10、精氨酸酶、TGFβ。
二 HBV感染时适应性免疫应答的作用及变化
适应性免疫应答在HBV清除中起着至关重要的作用。CD8+ T细胞可以通过细胞因子驱动的溶细胞和非溶细胞机制清除HBV感染的肝细胞。在肝损伤发生之前,血液中HBV特异性T细胞出现的时间与HBV DNA水平降低超90%的时间相一致,表明CD8+ T细胞分泌的IFNγ和TNFα介导的非细胞病变过程可清除大部分病毒。此外,HBV特异性CD4+辅助T细胞对于HBs特异性B细胞的成熟及CD8+细胞毒性T细胞(CTLs)应答的启动和维持是必不可少的。
HBV慢性感染者的适应性免疫特征与急性感染者有显著区别(图2),但无论临床和病毒学特征如何,慢乙肝患者间均具有高度的异质性。HBs特异性B细胞及不同HBV蛋白特异性的CD4+和CD8+ T细胞均以低频率存在,特别是在血液中,并表现出复杂的表型和功能。
HBV特异性T细胞在耗竭标志物的表达水平上表现出异质性,包括PD-1、TIM-3、Lag-3和CD160(图2A)。在功能上,慢乙肝患者的HBV特异性T细胞在增殖和细胞因子产生方面存在缺陷,但这种缺陷并不总是与抑制受体的表达水平相关,而与HBV抗原特异性相关。
慢乙肝患者中HBV特异性T细胞的其他特征与深层代谢和能量损伤有关(图2A),这可能使它们无法发挥抗病毒功能,并增加其杀伤NK细胞的倾向。
就体液免疫而言,外周和肝脏内的HBs特异性B细胞在可产生抗体的B细胞成熟方面存在缺陷,且与HBsAg水平或慢乙肝疾病阶段无线性关系(图2B)。
无论是否伴有炎症,肝脏中大量病毒抗原的长期呈递都可能导致T细胞和B细胞逐渐功能耗竭。且与慢乙肝儿童相比,成人的包膜特异性T细胞(CD8+和CD4+)优先耗竭。
总体而言,尽管慢乙肝患者体内存在逃逸T细胞和抗体的病毒突变,可能降低适应性免疫控制HBV的能力,但慢乙肝感染的总体标志是适应性免疫和先天免疫的复杂和异质性改变(异质性存在多种原因,如HBV感染剂量、年龄以及宿主的基因组成等)。
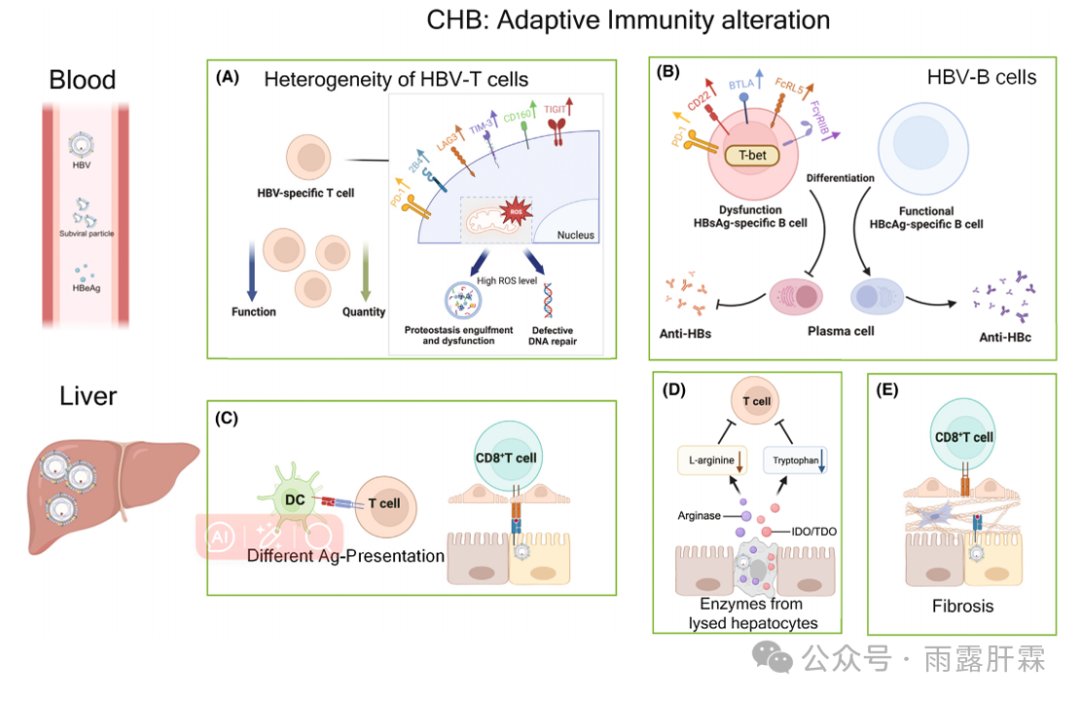
图2.慢乙肝感染中适应性免疫的变化
血液:
(A)HBV特异性T细胞数量和功能改变;检查点抑制剂标记物的异质表达,代谢途径的改变;
(B)选择性HBs特异性B细胞功能障碍。
肝脏:
(C)不同抗原呈递方式(髓细胞vs.肝细胞)诱导的HBV特异性T细胞的不同功能谱;
(D)溶解的肝细胞释放的酶(精氨酸酶、色氨酸-2,3双加氧酶)降低了T细胞功能必需氨基酸的可用性;
(E)纤维化增加降低了T细胞对HBV感染肝细胞的可及性。
三 肝脏的炎症状态可能对免疫系统造成一定影响
肝细胞损伤释放氨基酸降解酶(如精氨酸酶和色氨酸-2,3双加氧酶),降低了肝内精氨酸(T细胞功能必需的氨基酸)的可用性,或增加色氨酸的分解代谢物,从而削弱CD8+ T细胞的功能(图2D)。炎症过程也会上调调节性T细胞或髓系抑制性细胞,同时提高肝细胞和髓系细胞上PD-L1的表达(图1E)。此外,炎症条件下的骨髓细胞上调了前列腺素的产生,进一步培养了抑制HBV特异性T细胞功能的肝脏环境。持续的肝脏炎症也会引发肝纤维化,从而阻碍HBV特异性CD8+ T细胞通过椎间盘间隙到达被感染的肝细胞(图2E)。
四 总结
慢性和急性HBV感染者适应性免疫谱的显著差异导致其被过度简化,掩盖了慢乙肝患者中宿主-病毒相互作用的真实异质性,越来越多的研究表明慢乙肝患者的免疫谱是高度异质性的,往往与疾病阶段无关,这种异质性无法通过对病毒学和临床参数的选择性分析来预测。
近期的研究进展为将免疫检测纳入临床研究提供了指导,但其中仍存在两个重要的问题:
1.是否可以对血液样本进行有效地分析,或者是否需要进行肝活检?
2.慢乙肝免疫图谱的表征是否应该主要关注HBV特异性T细胞和B细胞,还是应包括更广泛的非抗原特异性免疫组分?
总体而言,希望能够通过共同努力对慢乙肝患者进行更合理的分层,用于临床管理及新疗法,不仅分析临床和病毒学参数,还应整合HBV相关免疫的全面概况。
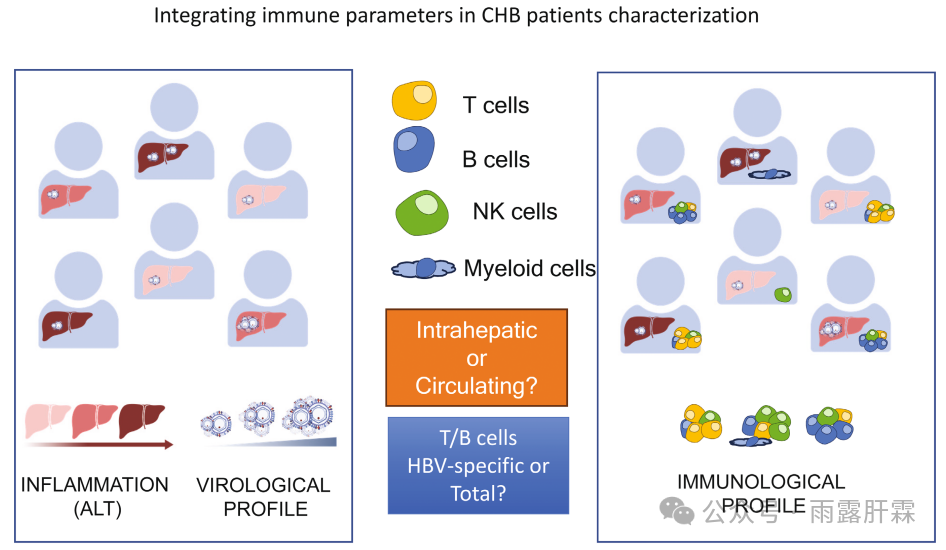
图3.在慢乙肝患者的特征分析中整合免疫参数
参考文献:
Bertoletti A. The immune response in chronic HBV infection[J]. J Viral Hepat, 2024.



