结节性淋巴细胞为主型霍奇金淋巴瘤的疾病生物学、风险分层和治疗
时间:2024-09-10 18:01:03 热度:37.1℃ 作者:网络
NLPHL
结节性淋巴细胞为主型霍奇金淋巴瘤(NLPHL)是一种罕见的惰性淋巴瘤,传统上认为是霍奇金淋巴瘤的一种亚型,但与经典型霍奇金淋巴瘤(cHL)不同,NLPHL的恶性细胞表达B细胞抗原,大多数患者表现为早期疾病。尽管有复发的可能,但大多数患者可获得良好的长期生存。因此,国际成熟淋系肿瘤共识分类(ICC)采用结节性淋巴细胞为主型B细胞淋巴瘤(NLPBL)这一术语。第5版的WHO分类则继续使用术语NLPHL,以配合正在进行的试验和研究,但也承认NLPBL是可接受的替代方案。
《Haematologica》近日发表综述,整合了对NLPHL中分子和遗传变化的理解进展,总结了最近提出的LP国际预后评分(LP-IPS),以及基于分期、疾病体积和危险因素所支持的各种治疗方案的最新证据。

流行病学
NLPHL仅占HL病例的5%至13%。白种人中有显著的男性优势,75%的患者为男性,但在其他种族群体中性别差异不太明显。NLPHL可发生于任何年龄,而在成年人中,患者的中位年龄在35至40岁之间。NLPHL患者的亲属发生NLPHL的风险增加,其中种系改变(如NPAT基因的缺失)可能是原因之一。免疫失调可能具有重要意义,因为已有文献报道免疫失调与自身免疫性淋巴细胞增生综合征和Hermansky-Pudlak 2型综合征之间的关联。某些人类白细胞抗原(HLA)亚型可能使患者易发生抗原刺激和淋巴瘤,正如卡他莫拉菌感染与HLADRB1* 04/07所示。
临床表现
大多数NLPHL患者都为局限期,约75%的患者为I期或II期。≥10cm的大包块不常见,仅在1-2%的病例中出现,而≥5 cm的大肿块(仍是不良预后标志物)在高达40%的病例中出现。通常情况下患者表现为无痛性淋巴结肿大,更常累及外周淋巴结,如颈部或腹股沟淋巴结。只有2~7%的患者有纵隔肿物,而cHL中高达60%。15~20%的患者有全身症状。结外受累不常见,5%的患者有脾受累,2-3%的患者有肝受累,1-2%的患者有骨髓受累。
诊断
形态学和免疫表型

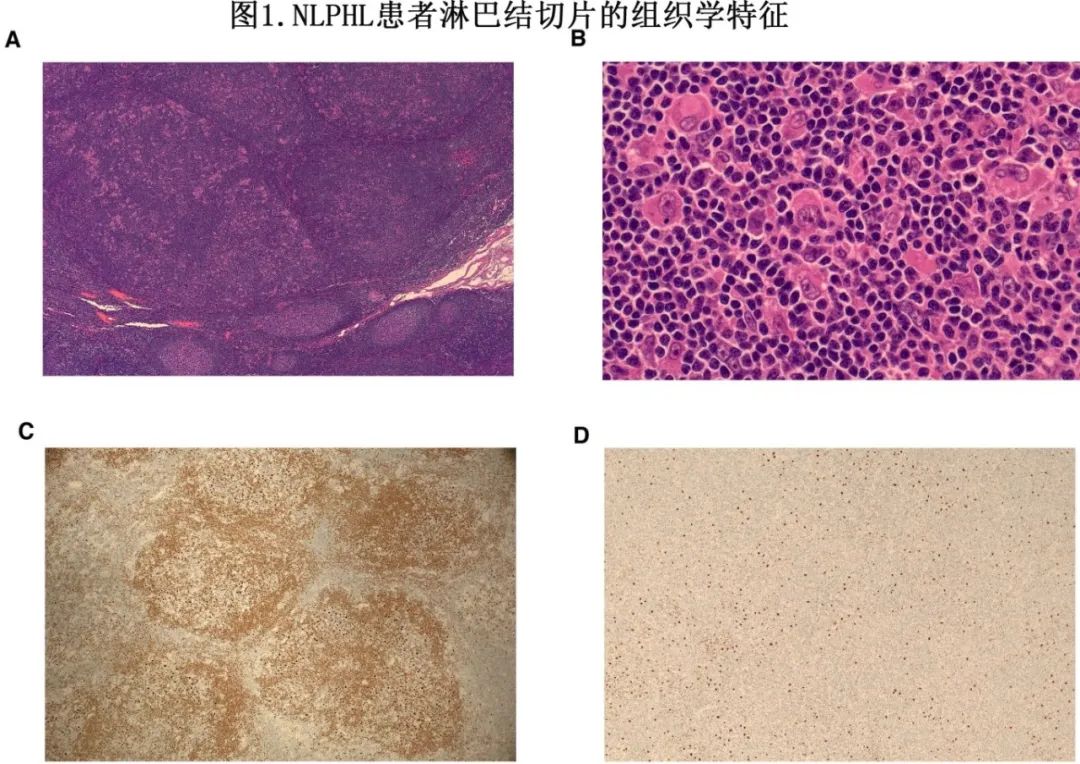
表1总结了NLPHL的形态学和免疫表型。淋巴细胞为主型(LP)细胞的免疫表型有助于区分NLPHL与其他疾病(如cHL)。将组织学结果与临床表现联系起来极为重要,因为存在特定的变异免疫结构模式(IAP)或可能的疾病转化可能影响治疗决策,特别是在具有侵袭性临床特征的情况下。图1为NLPHL淋巴结的典型组织学表现。
不同的免疫结构模式
NLPHL各病例间淋巴结标本的显微外观有明显差异,包括结节程度、LP细胞分布和背景细胞浸润。Fan等人描述了六种IAP进行分类(模式A到F),建立了经典型(A和B)和变异的生长模式(C到F)。75%的患者为经典型IAP,LP细胞主要存在于富含B细胞的结节中,包括“经典型”结节模式(模式A)和蛇形/相互连接的结节模式(模式B)。
IAP变体(variant)包括患者的变异生长模式(C到F)呈主要(>50%的淋巴瘤区域)或次要成分(<50%的淋巴瘤区域)。这些IAP变体的原因在于:突出的结节外LP细胞(模式C);结节内(D型)或弥漫性(E型)反应性T细胞的主要背景;或B细胞丰富但缺乏典型的结节型(模式F)。
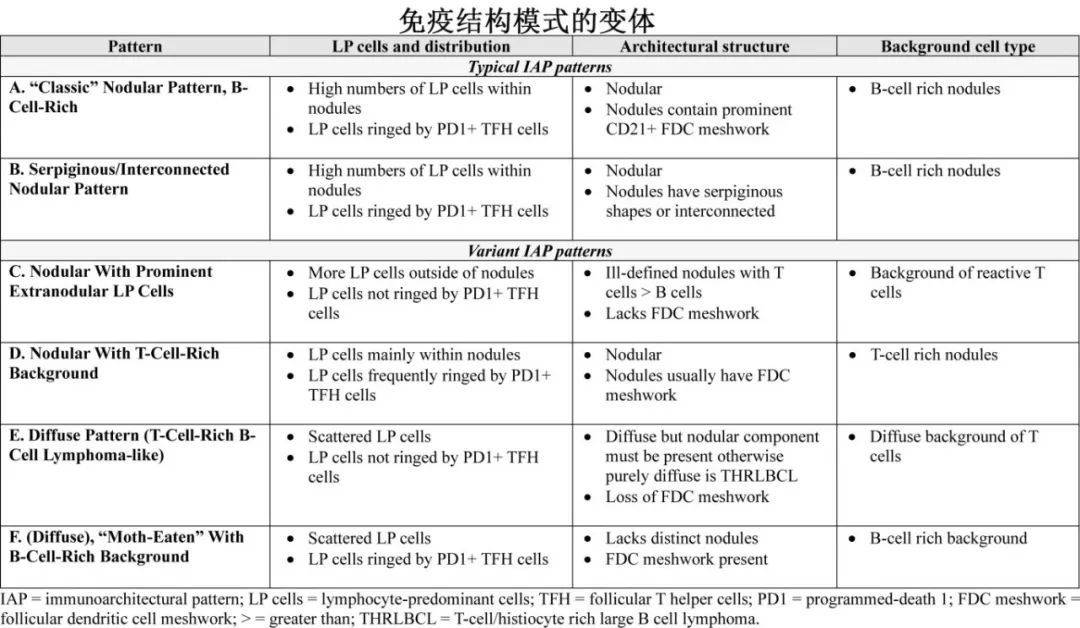
近期全球NLPHL One Working(GLOW)小组发表了一项大型国际回顾性研究,其中916例患者有可用的病理学来评估IAP。在IAP D和E患者中,III期或IV期患者的比例较高,而IAP F患者主要为早期疾病,预后良好;模式F未与其他具有更多不良特征的变异模式分组。
生物学
人们一直在努力更好地了解NLPHL患者的肿瘤微环境(TME)及其与临床结果的相关性。Hartmann等使用免疫组织化学(IHC)染色来表征淋巴结样本中的肿瘤细胞和TME。在96%的患者中,PD1阳性滤泡T辅助细胞在肿瘤细胞周围形成玫瑰花形,表明它们在NLPHL中起重要作用。
Younes等比较NLPHL和T细胞/组织细胞丰富的大B细胞淋巴瘤(THRLBCL)患者的淋巴结活检,以此来分析TME。利用单细胞水平的highplex成像和空间分析,证明典型和NLPHL变体和THRLBCL之间TME B和T细胞的组成、分布和相互作用存在明显差异。这证实了目前 NLPHL的分类方法,并表明单核细胞/巨噬细胞含量的增加可以区分THRLBCL和NLPHL变体E型。
除了常规的分期检查外,分子学或基因组检测目前仅限于研究领域。分子学检测已经确定了 NLPHL肿瘤细胞中JAK/STAT等信号通路中的常见突变。通过肿瘤细胞显微解剖的基因表达谱显示NLPHL和THRLBCL中表达的基因有显著的相似性,表明它们是密切相关的疾病。该结果已通过比较基因组杂交得到证实。
免疫球蛋白重链(IgH)的二代测序(NGS)已用于表征肿瘤细胞复发或转化为高级别B细胞 NHL时的克隆演变。转化性疾病患者的共同特征包括年龄较大、IgD阴性,以及IP细胞和基础B细胞的克隆性较高(更类似于B细胞NHL),缺乏大多数NLPHL患者所见的特征性IgH重排。
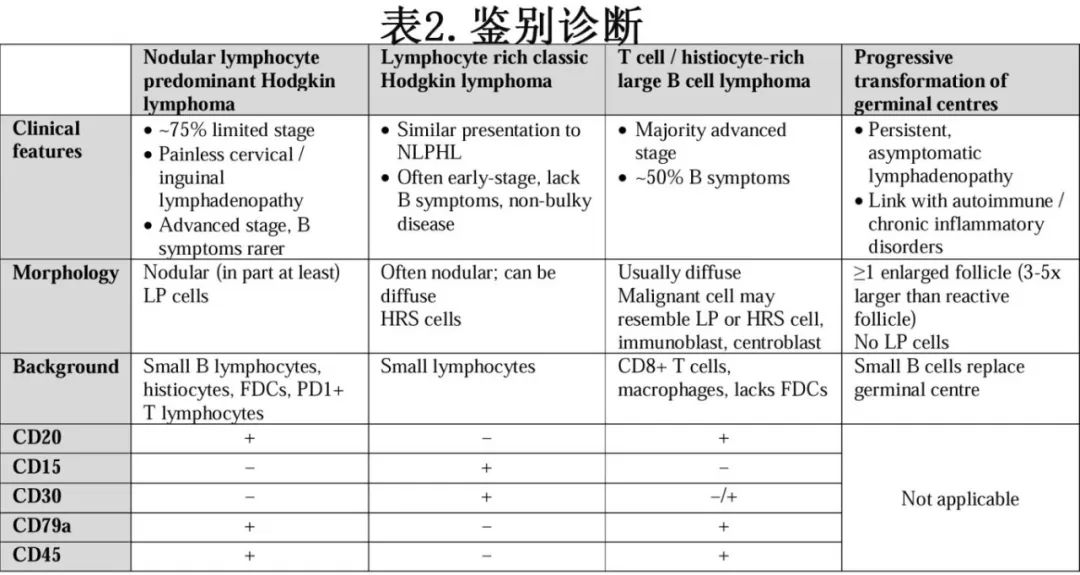
鉴别诊断
表2总结了关键的鉴别诊断以及形态学、基础细胞和免疫组化染色的差异。
分期和诊断检查
需要注意的一个关键点在于全身症状。血常规检查应包括乳酸脱氢酶(LDH)和乙型、丙型肝炎和人类免疫缺陷病毒的病毒血清学检查。由于骨髓受累率低,并且PET/CT能够灵敏地检测骨骼病变,因此不需要常规进行骨髓活检。
PET/CT扫描可显示受累淋巴结和结外病变部位,大包块的定义为淋巴结肿块≥10cm。分期使用Ann Arbor分期系统,而患者可以按照德国霍奇金研究组(GHSG)分为风险组,其使用分期和危险因素(如大纵隔肿块、结外病变、ESR和结区域数量)将患者分为早期、中期和晚期。
在可能的情况下,强烈建议进行淋巴结切除活检,而非粗针活检。较大的组织样本可鉴定LP细胞,并使足够的免疫组化染色区分NLPHL和LRCHL。此外,排除转化也很重要,而区分 NLPHL(特别是E型)与THRLBCL可能很困难,因为在小活检中结节性并不总是很明显。
预后
NLPHL患者通常比cHL患者预后更好,多为惰性病程,但仍存在持续复发和转化的风险。由于大多数患者表现为局限期,局限野放疗的生存通常与普通人群相当。III-IV期和年龄较大(>60-70岁)与预后较差相关。
大多数NLPHL患者具有良好的长期生存,10年PFS率为70-75%,10年OS率为~90%。但约有20%的患者在中位3~ 4年出现复发;在复发的患者中,约20%发生在诊断后10年以上;此外约30%的复发患者在诊断后24个月内早期复发。在HD7至HD15研究中治疗的患者的GHSG分析中,初诊后24个月内复发患者的10年OS为47.1%,而超过24个月复发的患者为95.9%。
患者的风险分层对于平衡疗效和毒性非常重要。减小晚期效应至关重要,因为GLOW数据显示10年淋巴瘤特异性死亡率较低,为3.3%;但该风险在60岁以上的老年患者和经历复发的患者中增加,特别是早期复发的患者中。此外,治疗相关毒性(包括第二恶性肿瘤和非淋巴瘤死亡超过淋巴瘤本身)也凸显了选择治疗的重要性。
IAP变体对预后的影响最近受到了挑战。尽管GHSG(报告5年PFS和复发率)和一个英国小组的分析表明,IAP变体与NLPHL儿童和成人的较差预后相关,但从GSHG开始的86个月的长期随访并未显示AB型和非AB型之间存在PFS差异;而D/E型患者的PFS较差,有统计学意义。GLOW组的916例可用病理患者的数据集进一步挑战了IAP变体与预后负相关的概念。在多因素分析(MVA)中,校正其他预后因素后IAP、PFS或OS之间没有关联,但 E变体与转化为侵袭性NHL的高风险相关(HR=1.81;P<0.05)。
许多研究小组已经开发了预后评分来对患者进行风险分层。GHSG在423例患者中证实临床和实验室结果(包括IAP模式)与预后相关,基于MVA评估的因素建立预后评分,包括IAP变体、男性和低血清白蛋白(<4g/dL),但该评分尚未在指南中广泛应用以指导治疗选择。
LOW小组今年提出了LP-IPS模型【JCO】结节性淋巴细胞为主型霍奇金淋巴瘤的LP-IPS模型,年龄≥45岁、III-IV期、血红蛋白<105 g/L和脾脏受累是PFS最具预测性的标志物,高LP-IPS评分与较差的PFS(HR=1.52)、OS(HR=2.31)、增加转化风险(HR=1.41)和淋巴瘤相关死亡(HR=2.63)相关。未来该评分可能有助于指导治疗降级或强化,并为未来前瞻性研究的设计提供信息。
评估复发和转化为侵袭性NHL
初始治疗难治性NLPHL患者或初始治疗后复发的患者应进行重复切除活检以重新诊断并评估转化,最常见的是向THRLBCL或DLBCL转化。此外,PET/CT扫描上的FDG摄取增高的淋巴结可能代表反应性淋巴结,包括生发中心进行性转化的淋巴结。2-17%的患者可转化为侵袭性NHL。脾脏受累、E变体IAP和既往化疗是转化的危险因素。NLPHL的复发和疾病转化可在初次诊断多年后发生,因此长期随访很重要。
治疗
作者整合各种国际指南和专家组的当前建议,提出以下治疗策略。
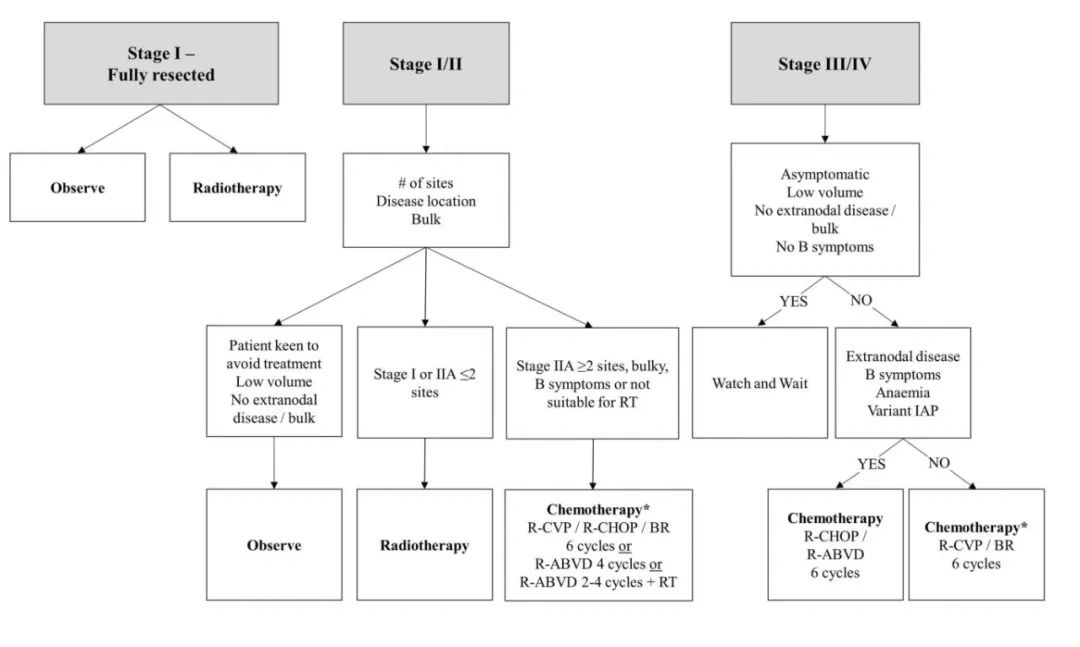
积极监测
由于NLPHL患者通常遵循惰性过程,因此可以考虑选择早期或无症状且肿瘤体积小的晚期患者进行积极监测,这也是在低级别B细胞淋巴瘤中采用的方案。尽管缺乏随机数据来比较早期NLPHL患者的主动监测与治疗,但回顾性分析的结果表明,对于不适合RT的患者和无结外或大包块疾病的患者,主动监测是一种合理的策略。
淋巴瘤研究协会(Lymphoma study Association)的一项回顾性研究纳入114例患者(I期67例;II期37例;晚期10例)。结果65例患者进展,中位PFS为56.4个月。复发时8例患者继续观察,而其余患者接受RT、利妥昔单抗±RT、化疗或联合治疗(CMT)。
纪念斯隆·凯特琳癌症中心(MSKCC)报告了37例接受积极监测的患者(早期23例;晚期14例),仅10例患者(27%)发生疾病进展,9例患者接受治疗(中位至治疗时间为61个月),大包块疾病和结外病变与较短的PFS相关。进一步的支持数据来自对美国国家癌症数据库(National Cancer Database)的分析,其中68例患者接受=积极监测,接受积极监测的患者与初始治疗的患者的OS无差异(HR=0.71;P=0.41)。
I期全切除
对于单个受累淋巴结完全切除的成人患者,常采用积极监测。可考虑采用受累部位放疗(ISRT)降低复发风险。国际淋巴瘤放射肿瘤协作组(ILROG)的一项多中心回顾性分析评估了I-II期淋巴瘤患者的结局,在32例切除活检后观察的患者中,25例患者完全切除且无任何剩余淋巴瘤患者的5年PFS为79.1%;而观察的患者(包括未完全切除的患者)5年OS为80.8%。在最初观察但后来复发的4例患者中,3例在复发时处于晚期。
适合放疗的I/II期疾病的治疗
ISRT是早期NLPHL患者有效的治疗策略,在许多IA期或IIA期患者中可提供与化疗或联合治疗(CMT)相同的结局。但不列颠哥伦比亚省癌症机构的数据表明,除IA期疾病患者外,对于早期NLPHL患者,CMT的预后优于单独RT。
治疗IA期以上早期疾病的实践存在差异。GHSG将无危险因素的IA期患者(推荐ISRT治疗)与所有其他早期或中期患者(I/II期,推荐CMT治疗)分开,分期和危险因素(大纵隔肿块、结外疾病、红细胞沉降率升高或≥3个淋巴结区域)可用于对患者进行分类,这符合欧洲肿瘤医学学会的建议,而NCCN支持单纯ISRT。在多学科团队会议上与血液科医师和放射肿瘤科医师讨论病例至关重要。
对于早期NLPHL患者,ILROG小组对1995年至2018年接受各种形式治疗的I期或II期 NLPHL成年患者进行了大型回顾性分析,包括I期患者307例和II期患者252例。5年时RT治疗(91.1%和99.4%)或CMT治疗(90.5%和99.4%)的患者的PFS和OS相同。该结果与GHSG结果一致,该分析专门研究IA期NLPHL患者,发现受累野RT(IFRT)与CMT的8年PFS和OS相当。
II期NLPHL患者可能适合ISRT,但对于疾病更广泛或预后不良的患者,可以考虑CMT或单纯化疗。回顾性分析表明,II期NLPHL患者的PFS低于I期患者。在ILROG分析中,II期患者和只有2个受累部位的患者单独RT仍可获得良好的疾病控制,而有>2个病变部位的患者单纯RT的 PFS较差。CMT的结果不受部位数量的影响,表明有>2个部位受累的患者可能从强化治疗中受益。对于非连续性II期疾病,RT或CMT的单因素分析无差异。
选择RT治疗时应考虑减少冠状动脉疾病、肺纤维化和第二肿瘤的风险,因为死于治疗并发症的患者多于死于淋巴瘤的患者。减少毒性的努力包括通过IRST降低放疗范围,可提供与延伸野或IFRT相同的5年PFS和OS率。RT的推荐剂量为30Gy每次1.8-2Gy,该方案来自cHL。未来还可能会评估更低剂量的RT以进一步降低毒性,例如4-24 Gy,其对低级别淋巴瘤非常有效。
不适合放疗的早期疾病和晚期疾病的治疗
抗CD20抗体治疗
利妥昔单抗已纳入NLPHL患者的化疗方案中。在复发患者中利妥昔单抗单药治疗的良好疗效使其在新诊断的患者中也得以评估。GHSG报告详细介绍了28例新诊断IA期NLPHL患者接受利妥昔单抗每周一次共4次治疗,剂量为375mg/m2。与RT或CMT等相比,利妥昔单抗单药治疗的10年PFS较差,仅为51.1%,但因为复发后治疗获得积极反应,10年OS为91.1%。由于利妥昔单抗的PFS较短,通常不推荐作为一线治疗,而推荐RT、化疗或CMT。
一项2期研究评估了利妥昔单抗治疗晚期患者,也探讨了利妥昔单抗作为新诊断和复发患者的维持治疗。利妥昔单抗组仅接受4次给药(每周一次),而维持治疗组则每6个月接受4次给药(每周一次)持续2年。在新诊断NLPHL患者(n=21)中,单独利妥昔单抗诱导组的5年PFS为41.7%,利妥昔单抗维持组的5年PFS无显著增加,为51.9%。尽管复发率高,但总生存期仍较好。
由于缺乏随机试验,利妥昔单抗对ABVD(多柔比星、博来霉素、长春碱和达卡巴嗪)、 CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松龙)或CVP(环磷酰胺、长春新碱、泼尼松龙)等化疗方案的附加效益难以量化。但为了限制博来霉素或蒽环类药物的长期毒性而加入利妥昔单抗可以增加CVP等方案的疗效,同时增加的毒性较低。来自FIL(Fondazione Italiana Linfomi)小组的回顾性数据表明,与单独化疗相比,化疗中加入利妥昔单抗可显著改善II期至IV期患者的PFS。化疗的5年PFS为72.7%,而免疫化疗为89.6%。R-ABVD的结果与R-CHOP的结果相当。
化疗
由于NLPHL的罕见性,很少有前瞻性试验指导治疗选择,而且大部分数据为回顾性。早期和晚期NLPHL患者在化疗方案的选择上存在显著差异。表3概述了支持用于各种化疗方案治疗成人 NLPHL的数据。
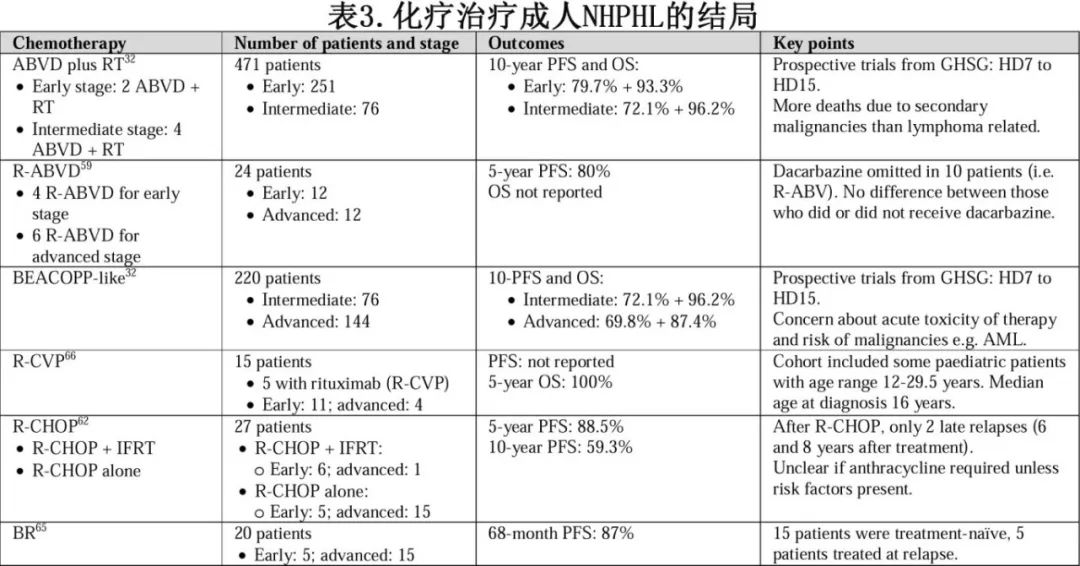
NLPHL患者传统上多使用cHL的治疗方案,因为HL的前瞻性试验纳入NLPHL患者。考虑到NLPHL的一般惰性以及显著治疗相关毒性的风险,如继发性恶性肿瘤和增加非淋巴瘤死亡,通常不推荐强化方案,如升级的BEACOPP(博来霉素、依托泊苷、阿霉素、环磷酰胺、长春新碱、丙卡嗪、泼尼松)。
当CMT用于早期/中期患者时,治疗包括两个周期(早期)或四个周期(中期)ABVD联合RT,10年PFS和OS率分别为79.7%和93.3%。但博来霉素、蒽环类药物和放疗的长期毒性令人担忧,而ABVD后不进行放疗的疾病控制不佳。
减少早期NLPHL患者治疗暴露的探索包括使用PET指导治疗。一项回顾性研究纳入99例患者,其中63例患者在PET时代接受治疗。2个 ABVD周期后进行PET扫描(iPET2),PET阴性患者基于2个额外周期的ABVD(后来改为 AVD,类似于RATHL研究),而PET阳性患者接受35Gy的受累淋巴结RT。在49例接受 iPET2的患者中,82%为PET阴性。PET指导组的5年PFS,PET阴性患者为92%,PET阳性患者为80%。单纯接受化疗且iPET2阴性的II期患者无复发。
由于许多分析的回顾性性质,单纯化疗与CMT的疗效是否一样很难得出结论。在ILROG报告中,一个较小队列的47例患者单独接受化疗,但与CMT相比,5年PFS较低,为77.8%对比90.5%;但患者包括B症状和结外病变发生率较高的高危患者。同样,法国Garciaz等人的回顾性报告显示,24例患者(早期,n=12)接受4个周期的R-ABVD治疗后,5年无淋巴瘤生存率达到80%。
晚期淋巴瘤患者的治疗通常为化疗联合抗CD20抗体,如果担心淋巴瘤持续存在,可考虑巩固放疗。如果识别复发风险较高或预后不良的患者,则可以选择可能受益于含蒽环类药物方案(如R-CHOP)的患者,高危特征包括B症状、大包块、结外累及(脾、肝、骨髓)和纵隔病变。
由于NLPHL是一种CD20阳性B细胞淋巴瘤,再加上担心复发和转化的持续风险,导致R-CHOP用于需要全身治疗的患者,包括单独治疗或联合IFRT。MD安德森一项回顾性分析了 27例接受R-CHOP治疗的患者,其中11例为早期,16例为晚期,5年和10年PFS分别为88.5%和59.3%。在早期患者中,CMT、单独化疗或单独RT之间没有PFS差异,但数量非常少;晚期患者(III/IV期)5年和10年PFS均为85.7%。
与R-CHOP相比,人们担心接受ABVD的晚期患者复发和高级别转化的风险可能更高。但在FIL组一项分析中,将利妥昔单抗加入ABVD显示出与R-CHOP相同的结果。
其他免疫化疗方案包括R-CVP和苯达莫司汀-利妥昔单抗(BR),疗效不错,但研究患者过少。在一项报道的20例患者中,大多数为晚期疾病(n=15),CR率为 90%,68个月PFS率为87%。虽然支持R-CVP的数据有限,但在低危患者中其可提供毒性和疗效之间的平衡。英国的一项回顾性分析详细介绍了15例接受CVP治疗的患者,其中5例接受利妥昔单抗治疗,5年OS为100%。值得注意的是,支持CVP的数据主要来自未使用利妥昔单抗和给予长春花碱而非长春新碱的儿童研究。
治疗反应评估
在接受化疗的患者中,中期PET/CT的作用尚不清楚,因为大多数患者对治疗有应答,但它可能在PET适应性治疗决策或存在与进展或高级别转化有关的症状时发挥作用。一项局限期 NLPHL患者中PET适应性治疗的BCCA研究显示,大多数接受化疗的患者可能会省略RT。然而在BCCA分析中,iPET2阴性的局限期患者忽略RT治疗的代价是额外两个周期的ABVD。重要的是,根据GHSG HD16研究的亚组分析,未接受额外治疗的iPET2阴性患者似乎复发率会增加。
复发/难治性NLPHL的治疗
大多数NLPHL患者在初始治疗后预后良好,而一小部分患者复发,且通常会多次复发。大多数疾病复发患者对进一步治疗有反应。由于大多数患者即使在复发时也有惰性的临床病程,因此可选择的治疗方案包括积极监测、单药抗CD20单抗、放疗或化疗。
对于复发时局限期患者,可选择RT或R-CHOP或R-CVP化疗(但需注意蒽环类药物终生暴露)。晚期患者可选择积极监测、R-CHOP或R-CVP。
具有更强侵袭性特征的患者预后较差,如难治性疾病(~1-2%的患者)、初始治疗后24个月内疾病进展(POD24,例如在GHSG分析中高达~30%的患者初始治疗后早期复发)和肝脏/骨髓受累。这些患者可能受益于强化挽救化疗,如DHAP(地塞米松、阿糖胞苷和顺铂)和自体干细胞移植(ASCT)。在欧洲血液和骨髓移植协会淋巴瘤工作组一份报告中,60例复发的NLPHL患者通过挽救化疗和ASCT实现了66%和87%的5年PFS和OS。
转化为高级别B细胞NHL的治疗
转化性疾病的治疗通常包括利妥昔单抗化疗伴或不伴ASCT,但具体临床实践各不相同,可能反映出患者既往接受的NLPHL治疗。在英国的一份报告中,26例转化性患者的5年PFS为60%,大多数接受了ASCT(62%)。法国的一项研究相似,在19例ABVD后发生转化的患者中,9例患者接受挽救化疗和ASCT, 10例患者接受常规化疗,所有患者的 10年OS为60%。
然而在ILROG小组的一份报告中,21例转化为DLBCL的患者主要接受R-CHOP治疗(n=15),只有2例患者接受ASCT,5年PFS和OS分别为62.2%和88.4%。然而,部分患者是在早期疾病接受有限治疗后发生进展。
因此,患者要么接受R-CHOP治疗,要么接受挽救化疗伴ASCT,决于患者的年龄和合并症,疾病转化在初始诊断时发生还是单独RT后发生,以及患者是否曾暴露于蒽环类药物。
未来发展方向
未来的方向包括新的方法来确定NLPHL患者的遗传特征,以及液体活检(如外周血)是否可以用来评估反应。此外,还需要确定如何将新药用于一线治疗或复发。
与肿瘤活检相比,循环肿瘤DNA(ctDNA)可更有效的对cHL患者淋巴瘤进行基因分型。ctDNA可根据碎片模式对患者进行遗传亚型,通过检测MRD来预测治疗反应和复发风险。该技术可应用于NLPHL患者,并可作为一种可量化的无辐射生物标志物。
在复发性NLPHL患者中使用新药的证据不足。GHSG最近发表的一项II期研究描述了 16例复发性NLPHL患者接受伊布替尼治疗,患者在6个周期后接受PET/CT再评估,并且达到疾病稳定或更好的患者继续治疗,最多治疗20个周期。虽然ORR为67%,但 18个月PFS仅为56.3%,7例患者出现进展或复发(中位10个月)。
有理由提出的其他新药包括PD1检查点抑制剂,因为大多数患者存在PD1+ T细胞。但只有一个病例报告详细描述了复发性NLPHL进展为THRLBCL的患者的成功治疗,帕博利珠单抗治疗后获得完全缓解。也只有病例报告支持使用免疫调节剂来那度胺,显示对复发NLPHL以及多次治疗失败的转化为THRLBCL的患者有效。
细胞疗法可能对NLPHL患者有效,包括T细胞衔接抗体,如CD3xCD20双特异性抗体或CD19 CAR-T细胞疗法。有一项正在进行的II期研究治疗新诊断NLPHL患者,每周使用利妥昔单抗或mosunetuzumab(CD3xCD20双抗)。
结论
尽管NLPHL罕见,但越来越多的证据有助于根据危险因素对患者进行分层,例如LP-IPS,但如何使用LP-IPS等工具来指导治疗决策还有待明确。对于大多数患者来说,选择一种将毒性降至最低的治疗方案至关重要,因为大多数患者的长期预后都很好。早期患者一般适合IFRT,除非有≥2个受累部位,或者有大包块,此时则建议单纯化疗或CMT。无症状、疾病体积小、缺乏危险因素的晚期患者可安全观察。对于需要治疗的晚期患者,确定可能从更强强的含蒽环类药物方案中获益的患者很重要。复发性患者的治疗选择取决于其对初始治疗的反应、至复发的时间、年龄和症状,但大多数患者对进一步治疗反应良好。强化挽救化疗和自体干细胞移植仅用于少数具有侵袭性疾病特征的多次复发患者或POD24患者。新型化疗药物的应用药物在很大程度上仍未被探索,原因在于NLPHL的罕见性,,但T细胞衔接抗体和检查点抑制剂等药物有望提供疗效。
参考文献
Ross T. Salvaris, Benjamin M. Allanson, Graham Collins, and Chan Y. Cheah.Nodular lymphocyte-predominant Hodgkin lymphoma: advances in disease biology, risk stratification, and treatment.Haematologica. 2024 Sept 5. doi: 10.3324/haematol.2024.285903


