武汉大学张先正教授团队AFM:可长期储存的聚多巴胺/卡介苗复合物介导的结直肠癌光热免疫治疗新策略
时间:2024-08-04 06:00:34 热度:37.1℃ 作者:网络
近年来,细菌疗法在肿瘤免疫治疗领域备受关注并取得了显著进展。但是,由于活细菌可能会引起机体不良反应,且其安全性难以把控,导致活细菌介导肿瘤治疗的临床应用仍然面临挑战和限制。为解决此问题,武汉大学张先正教授课题组报道了一种基于临床批准的卡介苗活菌疫苗(BCG)结合聚多巴胺(PDA)纳米粒子的肿瘤光热免疫治疗策略(图1),成功用于结直肠癌治疗。通过将两种冻干粉混合的便捷方式,PDA纳米粒子可共价键合到BCG上形成BCG@PDA复合物。该治疗策略将PDA纳米粒子介导的光热抗肿瘤效应与BCG疫苗引发的增强免疫反应联合,实现结直肠癌的光热免疫治疗。在小鼠结肠癌模型上验证了,该策略可显著抑制肿瘤生长。而且冻干的PDA纳米粒子可在-20°C下保存长达一年时间,且光热性能稳定。因此,该治疗策略展现出了很好的临床转化潜力。
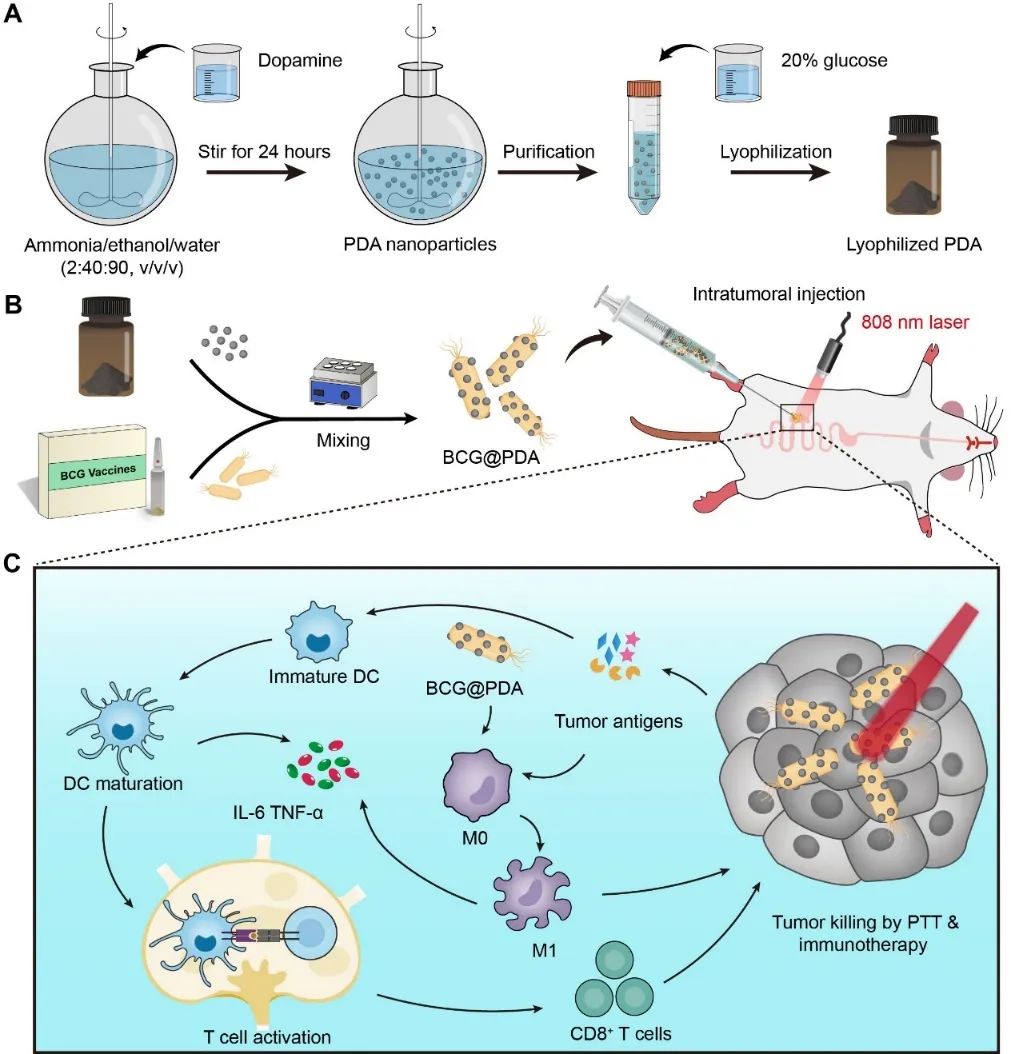
图1. BCG@PDA 的制备及其增强光热癌症免疫疗法的机制示意图。
为了提高纳米粒子的长期稳定性,作者通过使用不同的冻干保护剂优化了PDA纳米粒子的冻干存储。在添加葡萄糖作为冻干保护剂之后,PDA纳米粒子具有更小的尺寸和更好的均一性。并且,由此方法保存的PDA纳米粒子可以在-20℃下存储至少1年还能保持其光热性质和较小的尺寸(图2)。
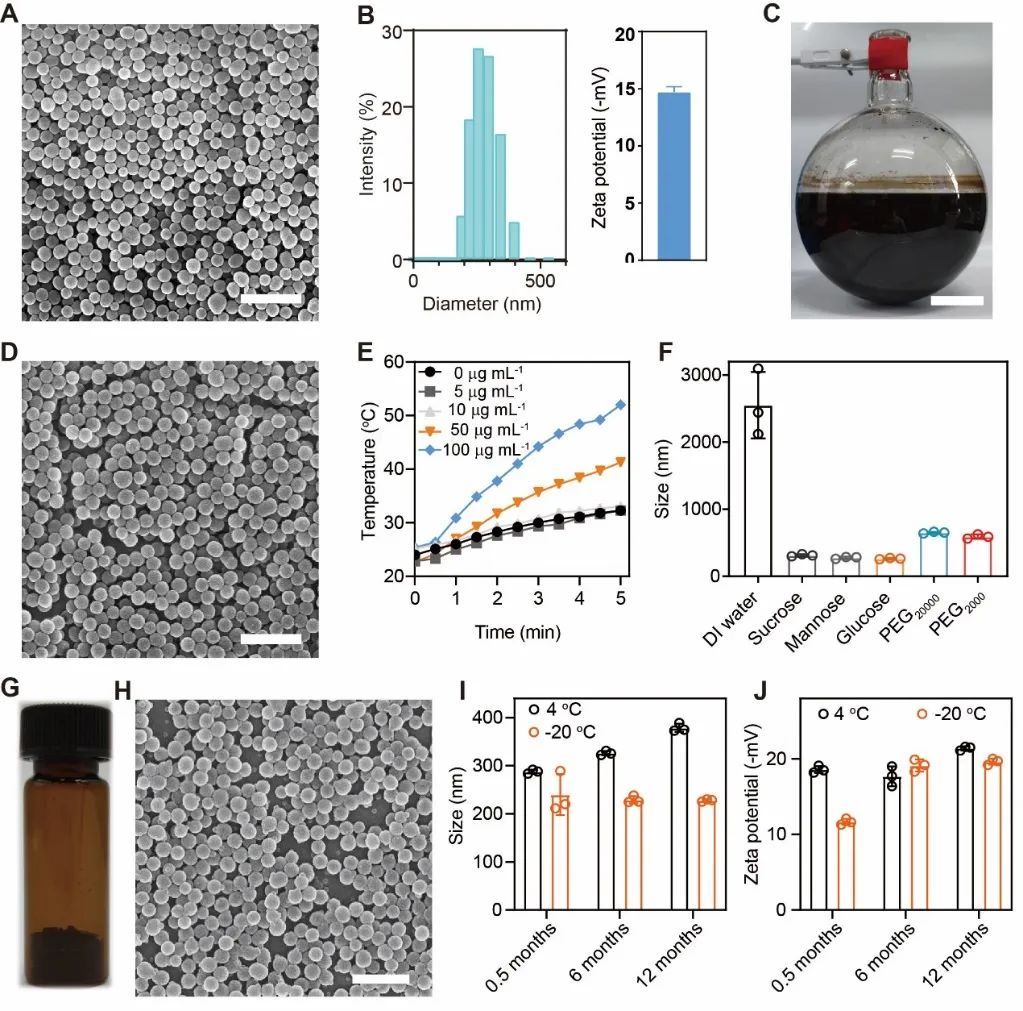
图2. PDA纳米粒子的制备及存储
为了探讨PDA纳米粒子和BCG联合策略的适用性和优势,作者通过SEM观察到PDA纳米粒子紧密结合在BCG表面。PDA结合细菌之后,其光热效果并没有发生明显变化。因此,通过简单地混合两种冻干粉剂就可以成功获得PDA纳米粒子修饰的BCG。此外,作者还探究了BCG在结合PDA后的免疫刺激作用。研究结果表明,粘附的PDA纳米粒子对BCG的免疫原性影响较小,PDA可在体外激活RAW264.7细胞,促进其由M2向M1表型转化。BCG@PDA在光照后可导致CT26细胞免疫原性细胞死亡,调高CRT的表达,释放HMGB1和ATP。这些信号也可以进一步激活巨噬细胞和树突状细胞(DC)(图3)。
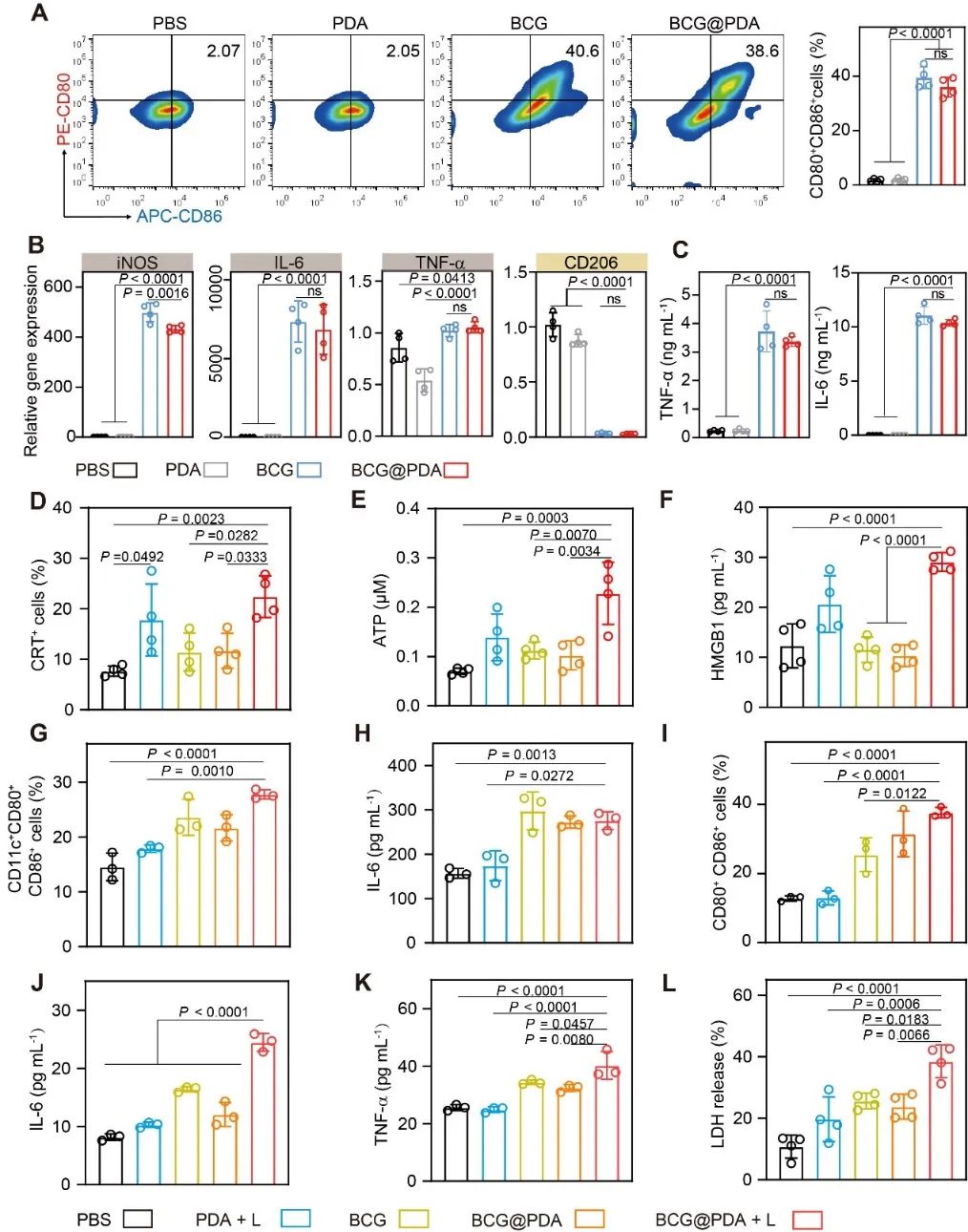
图3. BCG@ PDA 的体外免疫激活效果
作者进一步研究了BCG@PDA在小鼠CT26皮下肿瘤模型中引发免疫激活的效果。结果表明,BCG@PDA可以促进肿瘤区域的巨噬细胞向M1表型转化,促进更多成熟DC的激活,由此引发强大的抗肿瘤T细胞免疫反应(图4)。
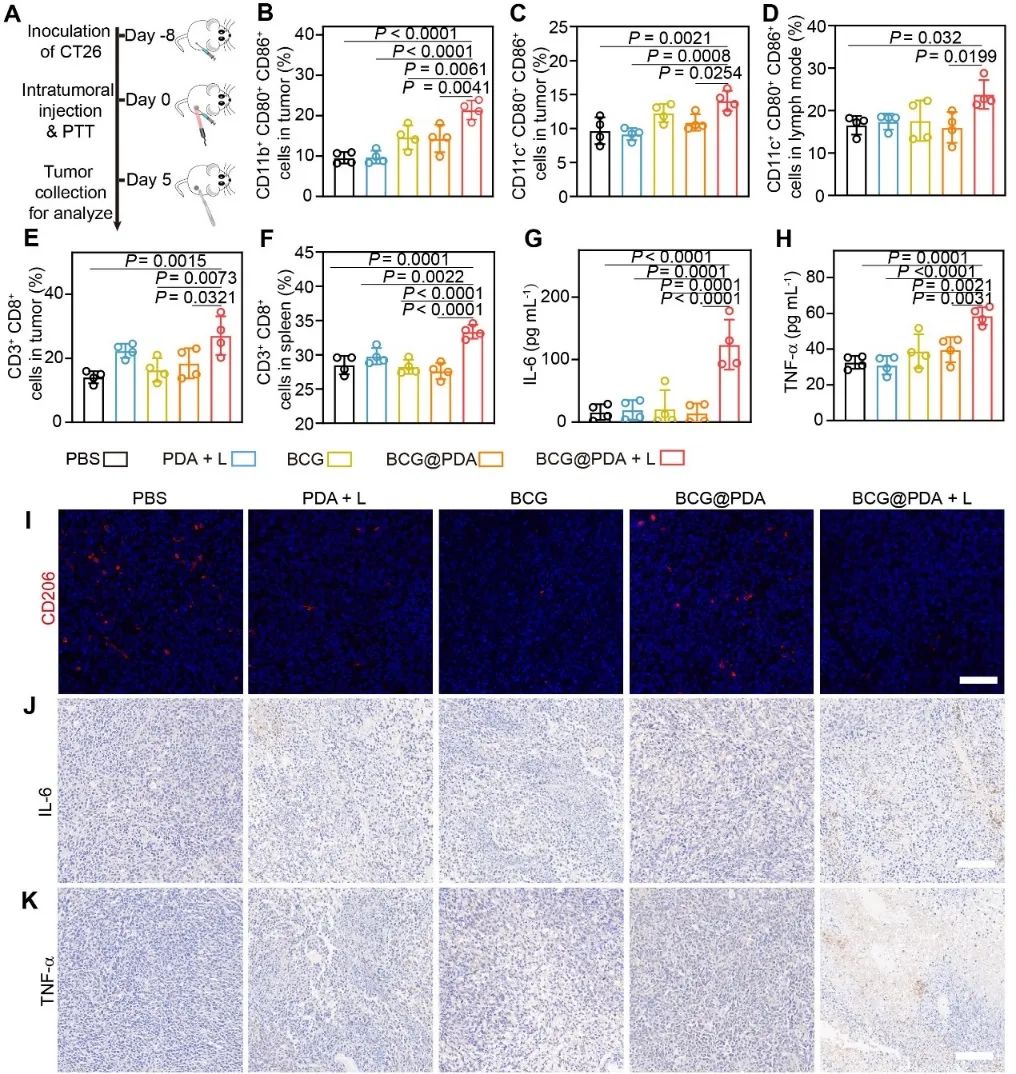
图4. BCG@ PDA 的体内免疫激活效果
体内研究结果表明,BCG@PDA能够大幅度抑制小鼠皮下CT26肿瘤细胞的生长,几乎完全清除了皮下荷瘤小鼠的肿瘤,并大幅延长了其生存周期。此外,作者还探究了这种治疗方式在小鼠原位CT26肿瘤中的治疗效果。研究发现,与对照组相比,BCG@PDA结合光照的治疗方式显示出了最佳的抗肿瘤效果。H&E染色结果也表明,BCG@PDA + L组并没有发现明显的病灶,进一步证实了这种治疗方式的有效性(图5)。
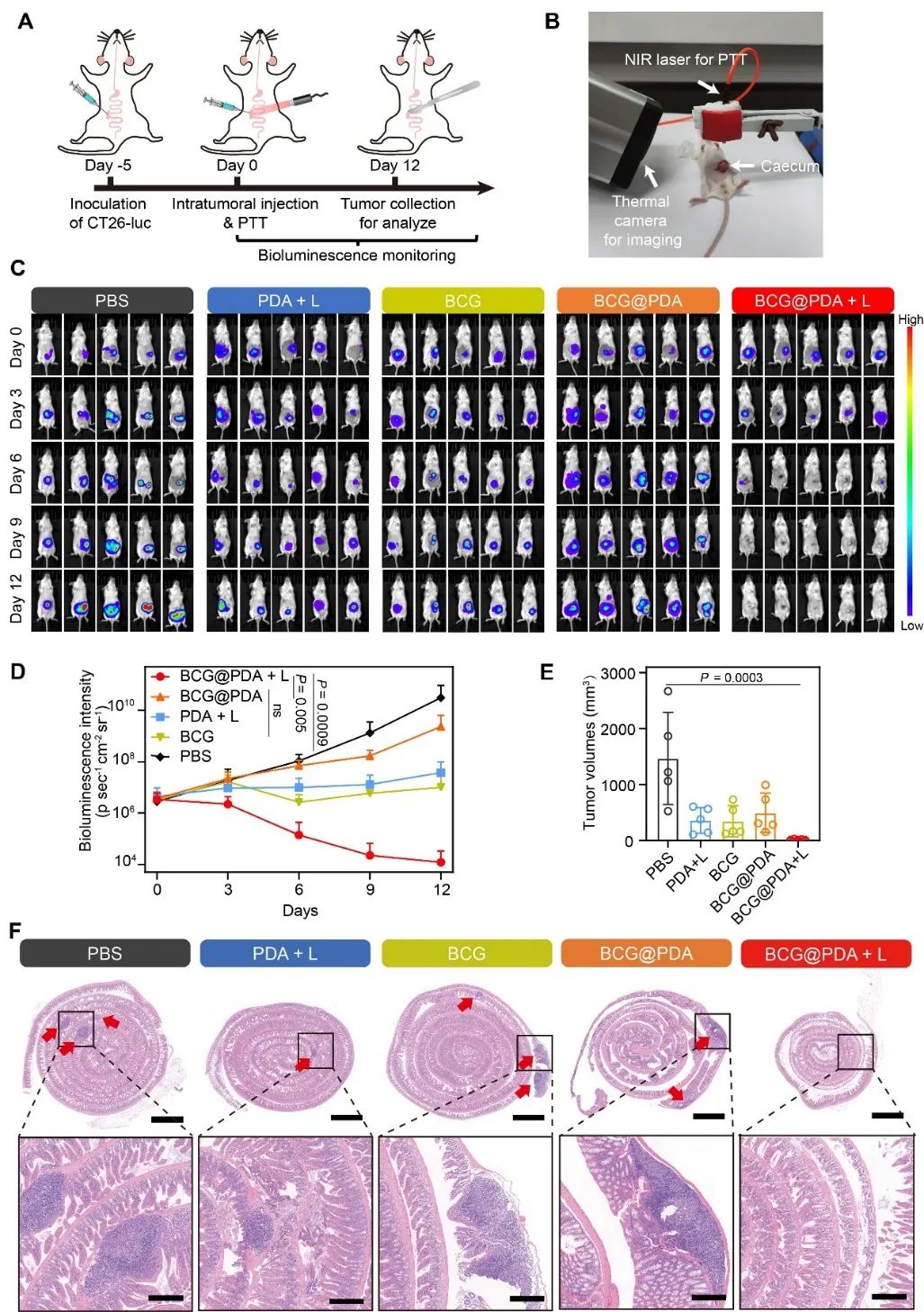
图5. BCG@PDA 光热-免疫治疗原位小鼠盲肠癌效果
综上所述,这篇论文探索了冻干的PDA纳米粒子与BCG结合用于光热免疫疗法治疗结直肠癌的潜力,发现这种组合能显著抑制肿瘤生长。由于冻干的PDA纳米粒子能在-20°C下稳定存储长达一年,此种组合策略显示出巨大的应用前景,有助于快速临床转化。
该研究以“Storable Polydopamine Nanoparticles Combined with Bacillus Calmette-Guérin for Photothermal-Immunotherapy of Colorectal Cancer”为题发表在《Advanced Functional Materials》上。武汉大学博士生庄泽南/祁永丹是文章的共同第一作者,张先正教授/钟振林教授/曾旋副教授为共同通讯作者。本研究得到国家自然科学基金委的支持。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202404381


