Adv Sci 暨南大学附属第一医院徐安定、逯丹/中山大学麦鸿成团队合作发现缺氧相关环状RNA经小细胞外囊泡转运的新机制
时间:2024-07-02 13:01:46 热度:37.1℃ 作者:网络
小细胞外囊泡(sEVs)作为细胞间通讯的纳米载体,携带蛋白质与核酸,在疾病发展中起核心作用。其负载内容依细胞状态而异,反映出细胞特定的生理或病理情况。缺血性卒中是神经内科最常见的疾病之一。缺血缺氧环境下神经细胞活动代谢发生改变,释放的sEVs随之改变。其中非编码RNA,如环状RNA (CircRNA)丰度的改变是潜在的疾病标志物和治疗靶点。明确CircRNA在细胞内的分拣和转运机制具有重大的科学价值。RNA结合蛋白(RBP)是RNA转运的重要执行者,常被认为与sEVs转运RNA有关。此外,缺氧应激条件下RNA和RBP形成的蛋白质相分离产物—应激颗粒(SG)是细胞在不利环境下,储存重要遗传信息的临时避难所。与此同时,SG的解聚和降解过程与外泌体的包装过程共享了部分的胞内环节。然而,RBP和SG在缺氧相关CircRNA转运进入sEVs过程中,扮演了什么样的功能和角色目前仍不清楚。
暨南大学附属第一医院徐安定教授、逯丹副研究员课题组在前期工作中首次报道了来源于缺血半暗带神经元的环状RNA-CircOGDH在急性缺血性卒中潜在的诊疗价值,其可通过sEVs转移到患者外周血中1,2。伴随RNA结合蛋白FUS进入到神经元缺氧sEVs中,FUS是外泌体分泌RNA的必要条件3。基于此,2024年6月26日,该团队联合中山大学麦鸿成副研究员在Advanced Science杂志上在线发表了题为“FUS selectively facilitates CircRNAs packing into neuronal small extracellular vesicles under hypoxia condition”的研究论文,动态揭示了缺氧条件下RBP分子 FUS介导的缺氧相关细胞质CircRNA装载到sEV的转运机制,解析了FUS和SGs参与调控缺氧相关CircRNA的sEVs转运的分子机制,并强调了FUS Zf_RanBP结构域特异性识别和结合特异性CircRNA在上述机制中的重要意义,阐述了缺氧相关CircRNA在细胞内经过FUS以及SG逐步传递并包裹入sEVs的演变过程4。

1、FUS蛋白经SGs向缺氧神经元外泌体(HypEVs)转运
首先,该研究发现不同阶段HypEVs的表征与其装载的FUS丰度有高度一致的变化。活细胞工作站的结果则提示,缺氧可诱导FUS的出核,并在胞质中与外泌体的标记蛋白CD63共定位,但两者共定位染色点的尺寸要远远大于外泌体的大小。在进一步的探索中,作者发现FUS和CD63共定位的染色点与缺氧诱导生成的细胞应激颗粒有关,并且SG中的FUS丰度与外泌体中的FUS丰度呈现“此消彼长”的变化。这里提示SGs可能参与了缺氧sEV的包装。
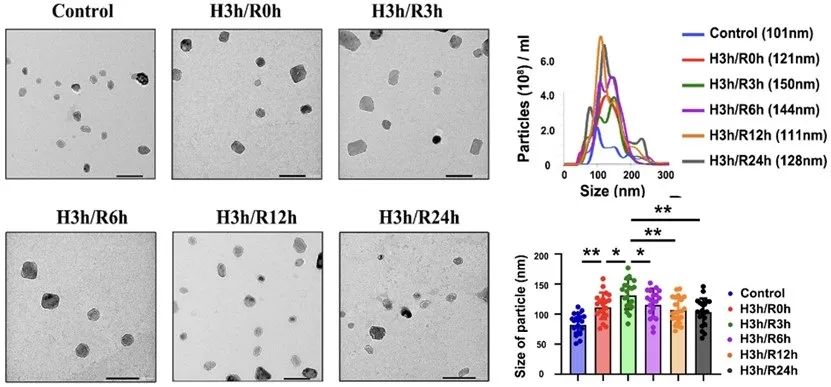
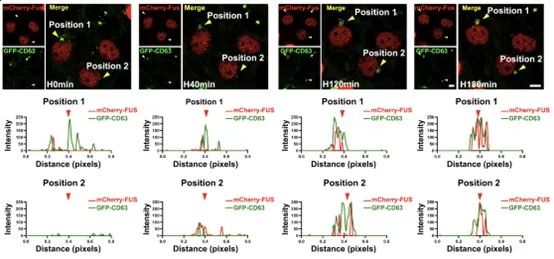
图1. 缺氧时FUS与HypEVs的表征和生成有关
2、缺氧条件下FUS介导缺氧相关的CircRNAs向SG募集,并最终向HypEVs转运
SGs是细胞应激时重要的RNA庇护场所,因此作者们进一步探究了FUS在SG中的定位,以及对SG募集胞质RNA的影响。他们利用一种基于化学点击的非特异性RNA标记方法,检测了在缺氧的不同阶段FUS与胞质非特异性RNA、SG标记蛋白G3BP1和外泌体标记蛋白CD63之间的共定位关系。结果显示,上述四者的胞内定位是高度统一的。而当敲除FUS时,则会导致缺氧细胞内应激颗粒数量的增加,但仅在一定程度上减少非特异性RNA在SG中的定位。基于此,作者进一步检测了FUS对缺氧相关的功能性环状RNA-CircOGDH胞内定位的影响。首先,通过RIP-qPCR检测和EMSA检测,他们验证了FUS能够与CircOGDH发生相互作用。而RNA原位杂交和qPCR结果表明,敲除FUS后,CircOGDH不再向SG募集,并在胞质中蓄积。这说明,FUS介导了特异性的CircRNA在SG中的定位。为验证该作用是否具有普遍性,作者利用RICK-seq (newly transcribed RNA interactome using click chemistry sequencing)获取了新生的缺氧相关CircRNA的表达谱,并筛选出4个代表性的缺氧相关CircRNA。以CircMAP2为例,作者得出了与CircOGDH高度一致的结果。
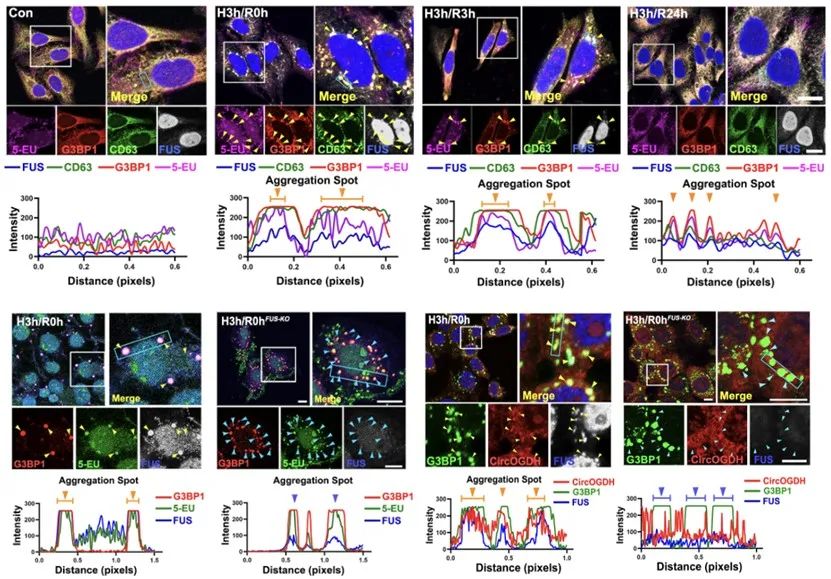
图2. FUS介导了缺氧相关的CircRNA向SG募集
此外,作者进一步论证了FUS介导特异性CircRNA向SG募集与CircRNA的外泌体转运过程之间的关系。他们通过调控SG生成和FUS的表达,观察了各种条件下外泌体表征的改变,以及其装载的特异性CircRNA丰度的变化。结果显示,抑制SG生成和敲除FUS均会大幅度减少外泌体中缺氧相关CircRNA的丰度,而敲除FUS的影响会更加显著。因此,作者得出了FUS经SG介导缺氧相关CircRNA向缺氧外泌体转运的分子机制。
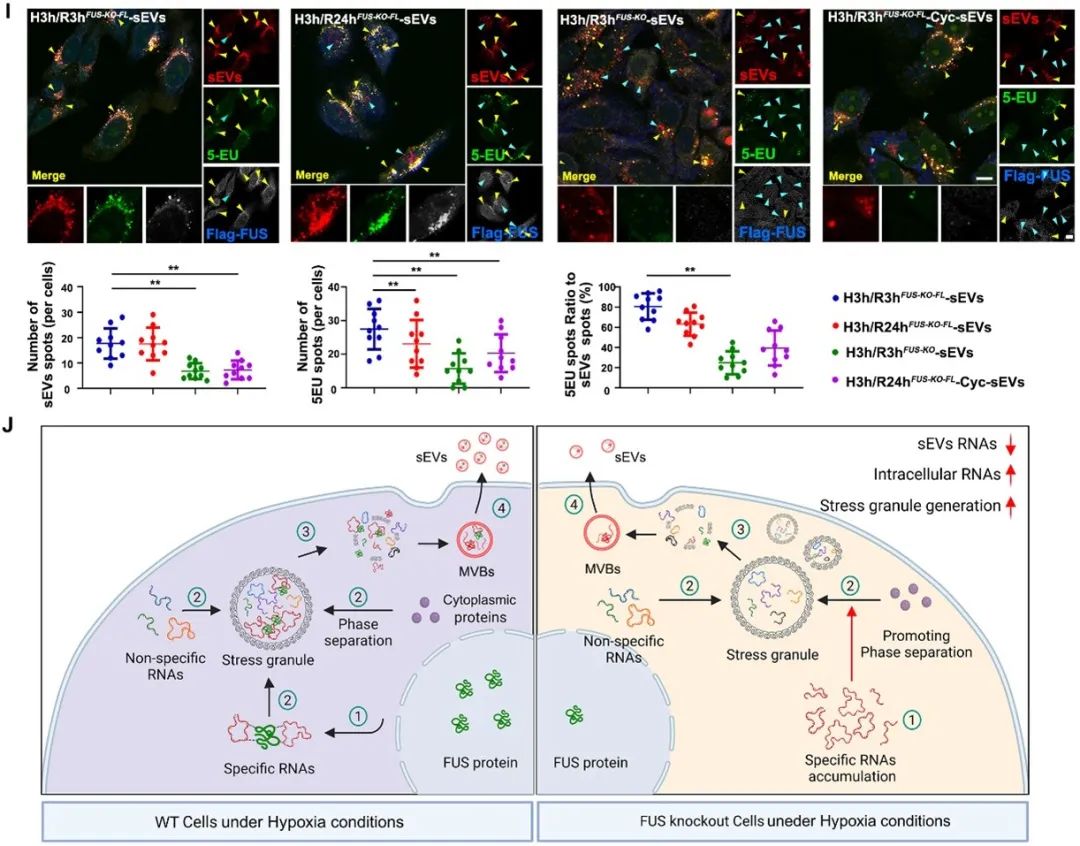
图3. FUS和SGs共同参与调控缺氧相关CircRNA向HypEVs转运的过程
3、FUS通过自身Zf_RanBP结构域选择性识别并结合缺氧相关CircRNA,并介导其向HypEVs转运
为明确FUS特异性识别并结合缺氧相关CircRNA的分子策略,作者通过RNAfold、3dRNA以及ZDOCK等工具预测和构建了FUS与CircOGDH和CircMAP2互作形成的复合体的空间结构和可能的结合区域。通过构建包含有不同功能区域的FUS截短肽段,他们验证得出Zf_RanBP是FUS特异性识别CircRNAs接头序列(junction reads)的关键结构域。接着作者通过构建删除了Zf_RanBP序列的突变FUS,进一步观察了FUS的Zf_RanBP结构域对其介导缺氧相关CircRNA向HypEVs转运的影响。结果显示,相较于全长的FUS,突变FUS会导致缺氧相关CircRNA在胞质中蓄积,无法介导其向SG募集并向外泌体转运。此外,他们利用增强交联的免疫沉淀测序(eCLIP-seq),进一步筛选了Zf_RanBP结构域特异性识别的RNA基序。因此,作者得出FUS可在缺氧条件下出核并在细胞胞质中的SG中凝聚;同时利用自身的Zf_RanBP结构域选择性识别并结合胞质中缺氧相关的CircRNA,一同向SG募集;当缺氧应激解除时,两者的复合体在SG解聚或降解后,被包装进入缺氧外泌体并最终向胞外转运。
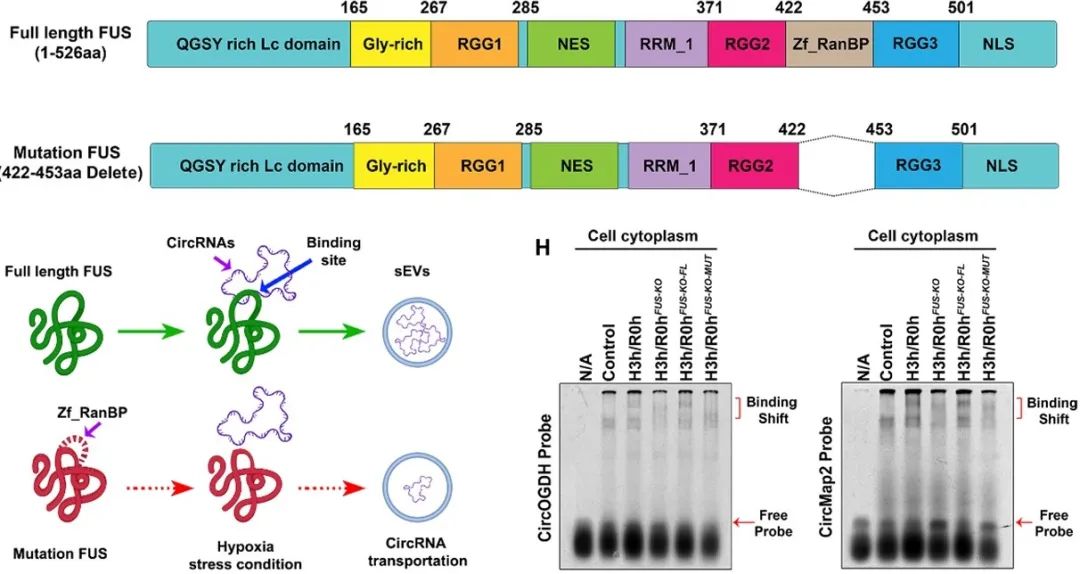
图4. FUS通过自身Zf_RanBP结构域介导缺氧相关的CircRNA向外泌体转运的过程
暨南大学附属第一医院为该研究的第一完成单位,臧建坤博士后(佛山市第一人民医院)、吴有盛博士后、苏璇琳博士、蔡凯微博士为本论文共同第一作者,逯丹副研究员、徐安定教授、麦鸿成副研究员(合作单位:中山大学孙逸仙纪念医院)为本论文通讯作者。
参考文献
(1) Liu, Y., Li, Y., Zang, J., et al. Tsang, C. K., Xu, A., & Lu, D. (2022). CircOGDH Is a Penumbra Biomarker and Therapeutic Target in Acute Ischemic Stroke. Circulation research, 130(6), 907–924.
(2) Penumbra-targeted CircOGDH siRNA-loaded nanoparticles alleviate neuronal apoptosis in focal brain ischaemia. Liu Y, Zhang T, Zou X, Yuan Z, Li Y, Zang J, He N, He L, Xu A, Lu D. Stroke Vasc Neurol. 2024 Apr 30;9(2):134-144.
(3) Wu, Y., Huang, X., Tan, Z., et al. Mai, H., Xu, A., & Lu, D. (2023). FUS-mediated HypEVs: Neuroprotective effects against ischemic stroke.Bioactive materials, 29, 196–213.
(4) Jiankun Zang, Yousheng Wu, Xuanlin Su, Kaiwei Cai, et al. Hongcheng Mai, Anding Xu & Dan Lu. (2024). FUS Selectively Facilitates circRNAs Packing into Small Extracellular Vesicles within Hypoxia Neuron. Advanced Science. 26:e2404822.
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404822


