ACS Nano:中南大学等团队研究制备双协同纳米调节剂减轻癌细胞外泌体分泌及其PD-L1表达以增强基于iRFA的肝癌免疫治疗
时间:2024-11-17 12:00:38 热度:37.1℃ 作者:网络
肝细胞癌(HCC)中不完全射频消融(iRFA)诱导的肿瘤免疫抑制微环境(TME)是肿瘤进展和转移的关键驱动因素。
2024年11月11日,中南大学Wang Duo、四川大学曹俊、广西医科大学刘军杰共同通讯在ACS Nano 在线发表题为“Dual-Synergistic Nanomodulator Alleviates Exosomal PD-L1 Expression Enabling Exhausted Cytotoxic T Lymphocytes Rejuvenation for Potentiated iRFA-Treated Hepatocellular Carcinoma Immunotherapy”的研究论文。该研究通过靶向外泌体生物发生、分泌和PD-L1表达来重塑iRFA后TME,从而恢复细胞毒性T淋巴细胞功能,减轻HCC的进展和转移。
利用聚多巴胺纳米调节剂的多功能特性,作者设计了一个靶向递送GW4869和氨氯地平(AM)的纳米平台,实现治疗药物的精确靶向和肿瘤特异性释放。GW4869是一种中性鞘磷脂酶抑制剂,与细胞内钙调节剂AM协同作用,以抑制外泌体生物发生和分泌。随后,AM触发PD-L1的自噬降解。体外和体内实验表明,这种协同方法显著增强了iRFA后各种功能性T细胞亚群的活化和增殖,特别是CD8+ T细胞、IFNγ+ CD8+ 细胞毒性T细胞、自然杀伤细胞和先天淋巴细胞。同时,有效减少了免疫抑制细胞类型的浸润,包括调节性T细胞和髓源性抑制细胞。TME重塑抑制了iRFA后HCC的进展和转移。总得来说,该研究将射频消融与免疫调节策略相结合,提出了一种增强HCC治疗效果的范例。

肝细胞癌(HCC)是一种高度侵袭性肿瘤,转移率高且生存率低,给临床治疗带来了巨大障碍。射频消融术(RFA)具备微创、安全和有效等优点,是HCC治疗的基础。然而,复杂的解剖位置和肿瘤异质性往往导致治疗参数出现偏差,发生不完全RFA(iRFA)。这种次优的治疗对一小部分肿瘤细胞造成亚致命性热损伤,但不能完全实现肿瘤根除。亚致死状态启动了复杂的生物级联反应,加剧了HCC的恶性进展和转移。
肿瘤免疫抑制微环境(TME)是导致HCC进展和转移的关键因素。值得注意的是,iRFA后肿瘤细胞表面的免疫检查点分子PD-L1显著上调,通过在T细胞表面结合PD-1有效抑制了T细胞活性和增殖,使肿瘤细胞能够逃避免疫监视和清除。而针对PD-1/PD-L1轴的免疫检查点阻断(ICB)疗法在HCC治疗中效果有限,仅有16-20%的患者发生良好的治疗反应,且通常伴随耐药性的出现。转录组学分析阐明了不同的iRFA后基因表达谱与ICB治疗临床耐药性之间的强相关性。表明仅依靠PD-1/PD-L1抗体疗法来逆转iRFA后HCC肿瘤微环境中免疫抑制状态的不足,限制了其抑制HCC进展和转移的潜力。因此,迫切需要探索更全面、更有效的治疗策略,破坏HCC的复杂免疫逃避机制。
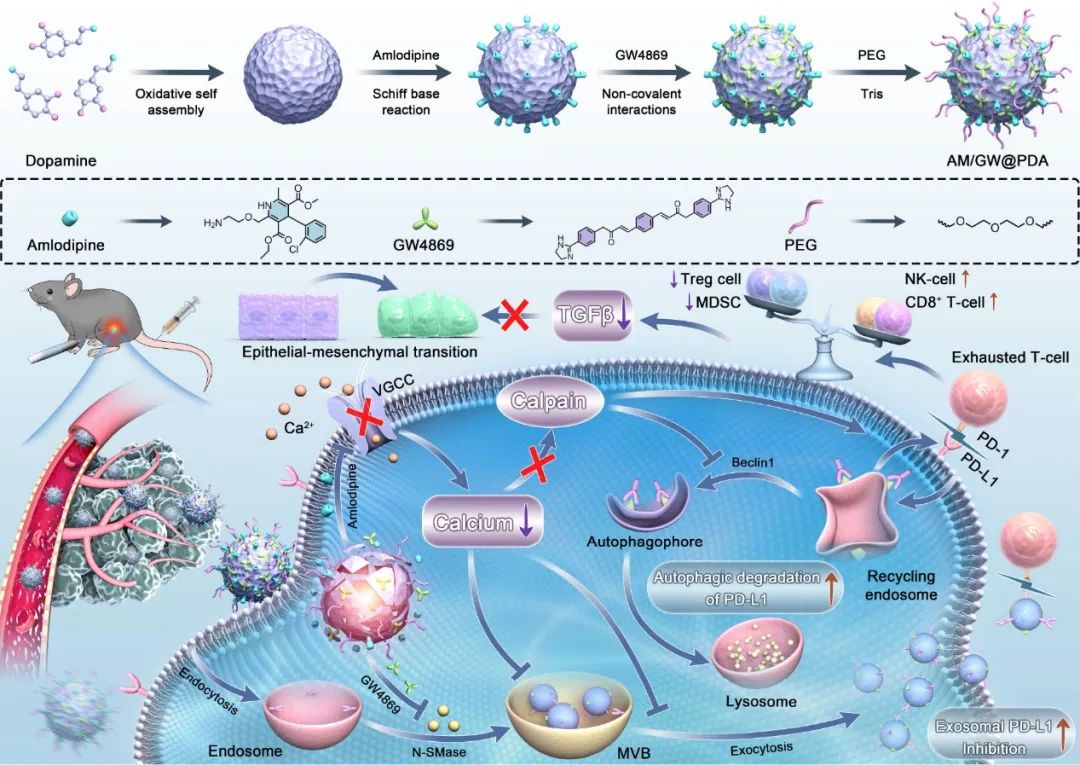
图1 双协同纳米调节剂AM/GW@PDA的制备及抗肿瘤治疗示意图(摘自ACS Nano)
近期研究表明,RFA诱导的热应激导致肿瘤细胞外泌体分泌升高。这些外泌体是关键的细胞间通讯介质,封装了多种生物活性分子,包括PD-L1、核酸和脂质,在重塑TME过程中起着关键作用。有趣的是,富含PD-L1的外泌体不仅减弱了T细胞功能,还抑制了中和免疫检查点抗体的能力,从而影响了治疗结果。此外,外泌体作为转运载体将PD-L1扩散到TME中的各种细胞类型,从而加强免疫抑制。上述发现阐明了外泌体PD-L1介导的PD-L1/PD-1免疫检查点阻断疗法的耐药机制,也为临床免疫治疗失败背后的复杂性提供了新视角。更重要的是,外泌体作为无数免疫抑制分子和致癌因子的载体和递质,共同驱动恶性肿瘤的进展。其能够到达远端器官(如肺),并促进受体细胞转化和血管生成,在促进HCC转移中发挥关键作用。肿瘤来源的外泌体及其PD-L1转运蛋白在介导恶性进化中发挥重要作用,靶向外泌体分泌并调节其PD-L1表达成为一种有效策略。其可以破坏其免疫抑制作用,恢复功能性T细胞活性和增殖,并最终在iRFA后重塑TME,以增强HCC患者的治疗效果和长期生预后。然而,对于TME、外泌体之间错综复杂的相互作用,及iRFA后PD-L1在HCC中动态表达的研究仍然有限。
该研究首先建立了细胞和动物模型来研究iRFA后HCC进展和转移机制。随后,提出了一种聚多巴胺基纳米调节剂共递送氨氯地平(AM)和GW4869的方法,以抑制外泌体生物发生和分泌,同时降解PD-L1。AM作为一种细胞内钙调节剂,触发PD-L1的自噬降解并破坏了外泌体的生物合成和分泌。GW4869是一种中性鞘磷脂酶(N-SMase)抑制剂,增强了对外泌体生物发生和分泌的抑制。这种双重协同作用显著降低了肿瘤微环境中外泌体的生物发生、分泌和PD-L1表达,从而重塑TME。体外和体内实验军验证了双重协同纳米调节剂的优异靶向特异性和功能持久性,确保了在肿瘤部位的有效累积。当与iRFA结合时,该方法显著减轻了外泌体的生物发生、分泌,并降低了其PD-L1表达。反过来增强关键T细胞亚群的功能和数量,尤其是CD8+ T细胞和IFN-γ+ CD8+ 细胞毒性T细胞。此外,自然杀伤(NK)细胞和先天淋巴细胞(ILC)等先天免疫细胞活性增加,同时减少了免疫抑制细胞(如调节性T细胞(Treg)和髓源性抑制细胞(MDSC))的浸润。这些免疫学变化促进了TEM的重塑,显著抑制HCC进展和转移。该研究不仅为HCC免疫逃避作用机制提供了进一步的见解,还提出了一种与RFA技术结合以改善HCC治疗结果的有效方法。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.4c11257


