快速了解ICU怎么优化使用抗生素
时间:2024-11-17 11:03:36 热度:37.1℃ 作者:网络
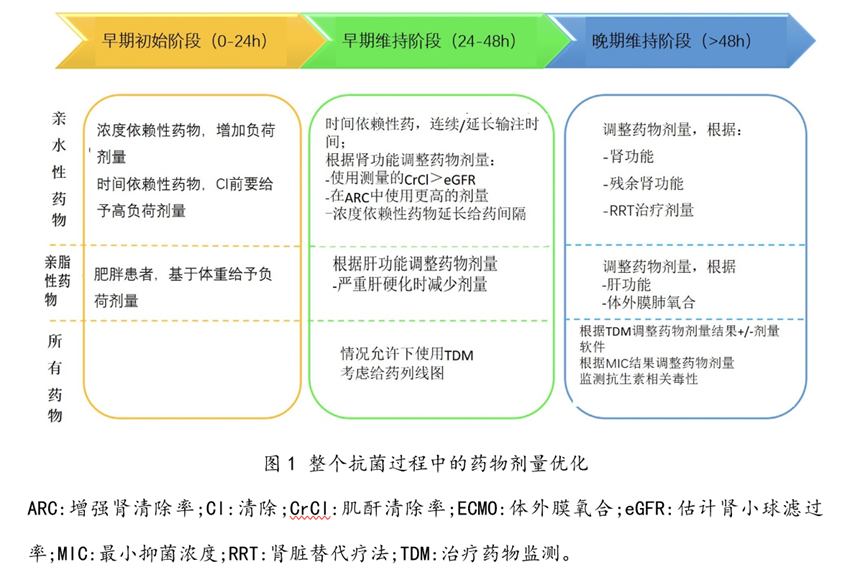
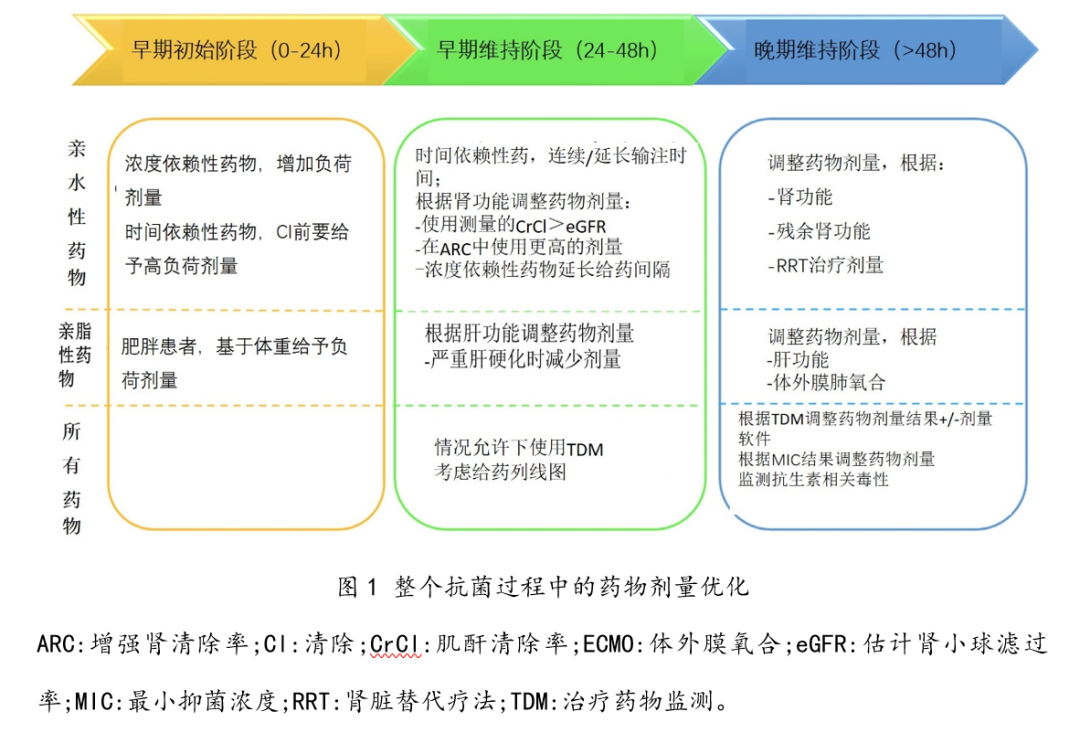
脓毒症的有效治疗需要及时给予合适的抗微生物药物,还需要精确给药。合适剂量是指给药后感染部位药物浓度达到治疗性剂量,确保良好的临床治疗效果和微生物反应,同时避免抗生素相关的毒性。
在危重疾病期间的病理生理变化可能会显著影响药物PK,主要影响以下两个参数:分布容积(Vd)和药物清除率(CL)。
分布容积VD增大
脓毒症期间大量液体从血管内转移到间质,增加了抗菌药物的Vd。低白蛋白血症常见于危重症患者,这可能导致药物-白蛋白结合的改变,进一步扩大了这些药物的Vd,Vd增加可能会降低最大血浆/血清药物浓度(Cmax)和总药物浓度,导致潜在剂量不足。
药物CL的改变
周围器官灌注受损,可能会阻碍药物的吸收和消除。肝血流量减少可能导致药物代谢减少。药物CL改变是危重患者调整维持剂量(MD)的关键决定因素。肾消除增强,也称为肾清除增强(augmented renal clearance,ARC),是危重患者的一种重要现象,可能显著影响药物PK。在ARC存在的情况下,亲水药物可能表现出CL的实质性变化。
药物吸收变化
危重疾病可能影响胃肠道,导致肠道蠕动减少、黏膜损伤和药物代谢改变。CU患者对环丙沙星等抗生素药物的吸收显著减少。
组织渗透的变化
脓毒症时,由于内皮功能障碍和微血栓的存在,微循环血流可能明显受损,组织灌注减少,导致感染部位抗生素暴露不,导致潜在的治疗失败、耐药性出现和更高的发病率。体外生命支持设备也可以导致组织渗透变化。
应用PK/PD方法优化危重患者抗菌治疗
1、制定合理的PK/PD目标;2、增加负荷剂量;3、抗生素的最佳给药方式:连续输注模式 吸入性抗生素;4、治疗性药物监测(TDM)和给药软件5、监测抗生素的副作用
危重病患者的新旧抗生素
重新定位旧抗生素
人们对旧的抗生素重新产生了兴趣,以解决细菌对常用抗菌药物增加的耐药性。由于一些旧的抗生素在体外对MDR细菌具有抑制活性,这些药物可能是治疗这些感染的另一种方法。然而,说明书中描述的临床适应症和用药建议尚未修改,可能不适用于危重患者。
新型抗生素
近期开发出了新的抗菌素药物,主要包括β-内酰胺和β-内酰胺酶抑制剂的组合。需要深入了解每种药物的微生物活性谱、PK/PD特性和每种药物的临床研究结果。
下面是详尽的全文翻译

摘要
脓毒症的有效治疗不仅需要及时给予合适的抗微生物药物,还需要精确给药,以提高患者的生存几率。合适剂量是指给药后感染部位药物浓度达到治疗性剂量,确保良好的临床治疗效果和微生物反应,同时避免抗生素相关的毒性。治疗性药物监测(Therapeutic drug monitoring,TDM)是目前实现这些目标推荐的最重要方法。然而,TDM并非普遍适用于所有ICU和所有抗菌药物。在没有TDM的情况下,医疗人员需要依靠以下几个因素来做出明智的剂量决定,包括病人的临床状况,致病病原体,器官功能障碍的影响(需要体外治疗),以及抗微生物药物的理化性质。在这种情况下,抗菌剂的药代动力学在不同重症病人之间,或同一病人在ICU住院过程中差异很大。这种异质性强调了需要个性化的剂量。本综述旨在描述危重病人病理生理变化及其对抗菌药物应用剂量的影响,并提供必要的实用性建议,可以帮助临床医生优化危重患者的抗菌治疗。
引言
危重病人的治疗对医护人员提出了独特的挑战,特别是在管理感染期间。这种情况下,抗生素在抗感染和改善预后方面,起着关键作用。然而这些患者中抗生素的药代动力学(PK)和药效学(PD)与普通人群有显著差异。了解这些病理生理学的改变对优化抗生素治疗至关重要。比如器官功能改变,组织灌注改变和液体平衡的变化,可显著影响药物吸收、分布、代谢和消除。因此,传统的给药方案可能达不到危重病人的治疗药物浓度。此外,这些患者的病理生理状况可能会影响抗生素的药效。实现杀菌效果最佳和抗生素耐药性最小化的需求,需要彻底了解药物与病原体相互作用的机制,这涉及到几个考虑因素,包括抗生素作用机制、感染病原体的最小抑菌浓度(MIC)和暴露时间。
这篇综述全面概述了危重患者的病理生理学改变,影响该人群抗生素PK和PD的主要因素,剂量优化的挑战,以及医护人员可采用的、确保抗生素有效治疗的策略。
ICU患者病理生理变化
在危重疾病期间发生的病理生理变化可能会显著影响药物PK。结合危重症早期的管理策略(如液体管理和血管加压剂),全身炎症反应综合征的发展(在大手术、创伤、烧伤或脓毒症的情况下)显著影响与给药相关的两个主要药代动力学参数,即分布容积(Vd)和药物清除率(CL)。
VD的变化
脓毒症期间血管通透性增加和水肿的进展,可能导致大量液体从血管内转移到间质,增加了抗菌药物的Vd。值得注意的是,危重疾病的初始管理,通常使用液体、肌力药物和血管升压药,加剧了这一现象。亲水药物(特别是𝛽-内酰胺、氨基糖苷类和万古霉素)Vd较低,更容易受到这些病理生理变化的影响。诸如胸腔积液、腹水和手术引流液等因素可能会进一步扩大这些药物的Vd。
低白蛋白血症常见于危重症患者,超过40%的ICU患者基线血清白蛋白浓度低于25 g/L。这可能导致药物-白蛋白结合的改变,特别是对血浆蛋白高度结合的ICU常用药物,包括头孢曲松、头孢唑林、厄他培南、棘白菌素和替考普兰,这些药物显示出相当高的血浆蛋白结合,其水平高达95%。因此,低白蛋白血症可能导致血液中未结合药物的比例增加,自由地分布到组织中,进一步扩大了这些药物的Vd。随着时间的推移,Vd增加可能会降低最大血浆/血清药物浓度(Cmax)和总药物浓度,导致潜在剂量不足,仅达到亚治疗浓度。在治疗初始阶段,可能需要增加剂量,并需要根据未结合的药物水平进行调整。
药物CL的改变
随着疾病进展,器官功能恶化,可能导致多器官功能障碍综合征。这种情况下,周围器官(如胃肠道和肾脏)灌注受损,可能会阻碍药物的吸收和消除。此外,肝血流量减少可能导致药物代谢减少,与肝代谢需求旺盛和具有较高摄取率的药物尤其相关。慢性肝功能衰竭可能进一步影响肝脏药物代谢,导致药物剂量减少。在这种情况下,严重肝硬化患者棘白菌素的剂量减少。
药物CL改变是危重患者调整维持剂量(MD)的关键决定因素。肾消除增强,也称为肾清除增强(augmented renal clearance,ARC),是危重患者的一种重要现象,可能显著影响药物PK。在临床实践中,尿肌酐清除率(CrCl)值≥130 mL/min/1.73m2是最常用的定义ARC的临界值。液体复苏和血管升压药引起的高动力状态,可能导致肾脏等主要器官的血流量增加,从而增加肾脏消除。肾功能储备的概念也用来解释ARC的潜在机制,指肾脏能够通过动员肾单位、增加肾血流量和高滤过来增加肾小球滤过率,见于某些情况下,如全身炎症反应综合征、创伤、烧伤和妊娠。在患有神经系统疾病的人群中,脑-肾之间的交互认为是一种潜在机制。值得注意的是,自主神经调节失调可能导致肾脏和脑灌注变化,而交互效应可能增强两个器官灌注的整体调节。发生ARC的危险因素包括年轻、脓毒症、创伤、手术或神经外科手术、发热性中性粒细胞减少和烧伤。主要通过肾脏清除的,在ARC存在的情况下,亲水药物可能表现出CL的实质性变化。在对危重症患者队列研究中,Udy等人证明了肌酐CL增强和β-内酰胺暴露不足之间有很强的相关性。一些观察性研究也在创伤性脑损伤和脓毒症的病例中报告了类似结果。
在此背景下,一项针对危重患者(接受医院获得性或呼吸机相关肺炎[VAP])治疗的回顾性单中心研究发现,高剂量β-内酰胺方案与改善预后(低治疗失败率和复发率)相关,而不增加不良事件。值得注意的是,对ARC的推荐剂量最近已添加到新的抗生素说明书中。
评估肾小球滤过率的方法值得特别考虑。Cockroft-Gault, Chronic Kidney Disease Epidemiology Collaboration, 和Modification of Diet in Renal disease equations研究已证明低估了危重症患者的肾功能。因此,为了更好地识别接受亲水抗生素(如β-乳酰胺、万古霉素或氨基糖苷类)治疗患者的ARC,必须评估每日测量的CrCl。在这种背景下,最近一项研究发现,队列中大多数患者在入院第一周内发生ARC,有一半在3天内发生。ARC持续时间差异很大,中位时间和最长时间分别为5天和1个月以上。
值得注意的是,肾脏消除功能的改变,也可导致不同程度的肾损害。
在ICU住院的患者,50%以上出现急性肾损伤,20%-25%在第一周需要肾脏替代治疗(RRT)。这种情况下,肾功能损害患者的抗菌药物剂量要复杂得多。诸如RRT等体外支持进一步增加了解读或预测抗菌药物PK的复杂性。这种情况下,药代动力学的变化取决于体外回路的特性,如膜通透性、治疗强度和药物本身的理化性质(包括分子大小、电离程度、蛋白质结合程度以及亲水性或亲脂性)。残留肾功能也有助于药物排泄,可能是这种情况下计算最佳药物剂量时的另一个混杂因素。由于抗生素浓度在同一重症患者住院不同时间段和不同危重症患者之间的差异很大,这种情况下接受RRT,选择最佳的经验性抗菌方案是个复杂的临床挑战。一项大型前瞻性、观察性、跨国药代动力学研究显示,抗生素给药方案和RRT处方存在相当大的差异性(4-8倍)。美罗培南和哌拉西林的中位谷浓度(12.1 mg/L和78.6 mg/L)大多高于药物疗效推荐浓度(分别为2 mg/L和16 mg/L)。总的来说,4%-5%的病例显示药物水平不足,25%-35%显示药物浓度过高(因此存在潜在毒性风险)。之前一项关于RRT患者的研究发现,未调整广谱β-内酰胺方案(类似于肾功能正常的患者)的患者存在药物过量。值得注意的是,在接受未调整给药方案的患者中,肾脏损害已确定为神经毒性的一个危险因素。在可能的情况下,应考虑低肾脏清除或持续RRT相关CL的替代抗菌素,以限制这种环境下不合理抗菌药物剂量的风险。
药物吸收变化
在危重患者中曾有过药物吸收改变的报道。然而,对于这些变化的管理并没有明确的建议。危重疾病可能影响胃肠道,导致肠道蠕动减少、黏膜损伤和药物代谢改变。肠内药物的吸收和有效性难以预测,这主要是由于胃pH值的波动、肠内结构破坏和酶活性降低。此外,胃排空延迟延长了达到最大浓度所需的时间。ICU患者对环丙沙星等抗生素药物的吸收显著减少,可以反映这些病理生理改变的影响。
组织渗透的变化
抗生素向组织的运输以及随后在组织和细胞内的分布取决于各种因素,包括药物本身特性、患者特征(如肥胖)、疾病严重程度和靶组织。
值得注意的是,在危重症患者中不同抗菌药物组织穿透性有所改变。据文献报道,这些改变程度在不同的组织和器官中差异很大。脓毒症时,由于内皮功能障碍和微血栓的存在,微循环血流可能明显受损,组织灌注减少,导致感染部位抗生素暴露不,导致潜在的治疗失败、耐药性出现和更高的发病率。血浆浓度达标,但会出现组织浓度不足,因为血浆中的抗生素浓度不能准确反映受感染组织中的抗生素浓度。有趣的是,临床评分系统,如组织渗透预测评分,已经用于预测抗菌素的组织渗透。与组织渗透相关的主要因素包括氧饱和度,血清乳酸水平,以及去甲肾上腺素剂量。虽然抗菌素的组织/血浆渗透率可能是选择最合适治疗方法的重要因素,但目前尚无确凿的证据支持使用临床评分来调整抗生素给药方案。此外,与组织渗透有关的数据有限,无法用于指导抗菌药物剂量。
体外膜氧合(ECMO)是一种先进的生命支持系统,用于危及生命的呼吸或心脏衰竭患者。能提供心肺支持,并可作为恢复、肺或心脏移植,或植入长期心室辅助装置的桥梁。研究已经评估了ECMO过程中PK的决定因素,特别是ECMO回路对药物分布和消除的影响。ECMO回路由血泵、氧合器、加温器和管道组成,可以扣押药物,改变表观Vd,并影响药物CL。对药物的扣押程度取决于物理化学性质(亲脂性和蛋白结合力)和管路因素(膜表面积、管类型、使用氧合器和预冲溶液),新技术降低了风险。表观Vd的变化受到关键疾病相关因素的影响,ECMO回路的加入会导致药物扣押和预冲液对血液的稀释。血液稀释对表观Vd较大药物(如喹诺酮类药物)的影响比对低Vd药物(如β-内酰胺和氨基糖苷类药物)的影响要小。由于ECMO期间肾和肝灌注减少,药物CL通常减少。因此,在ECMO和RRT联合使用过程中估计PK参数是相当具有挑战性的。这种情况下,几乎一半接受ECMO治疗的患者需要RRT;两个体外回路的存在进一步增加了药物PK的复杂性。一种包括机械体外实验、动物模型和临床研究的综合方法,已用于指导ECMO患者的优化给药。
应用PK/PD方法优化危重患者抗菌治疗
PK/PD目标
PK/PD目标可以表示为Cmax/MIC、%T > MIC或曲线下面积(AUC)/MIC,取决于抗生素是否表现出剂量、时间或AUC依赖性。指导β-内酰胺给药的最佳PK/PD目标尚不清楚。在危重症患者中,游离浓度100%高于MIC(100% fT > MIC)的时间通常作为β-内酰胺的治疗目标。更激进的𝛽-内酰胺目标值((例如 4–5 × MIC))也认为可以尽量减少微生物治疗失败和/或耐药性的发生。Tam等发现,在治疗铜绿假单胞菌期间,Cmin/MIC比值为1.7,较比值为6,更容易出现耐药性。意大利最近一项研究,危重症患者稳态浓度/MIC比值≤5确定为革兰阴性细菌感染治疗失败的独立预测因子。临床试验中观察到一致的结果,这些试验专门针对临床或微生物治疗失败的感染,如由铜绿假单胞菌和肺炎克雷伯菌引起的医院获得性肺炎(VAP)。这些试验表明, Cmin/MIC比值>4-5能改善临床结果。值得注意的是,使用更高的目标比值,是基于对组织扩散和有关MIC和β-内酰胺浓度测量技术不确定性的考虑。然而,只有观察性研究表明,更高的PK/PD目标值,可以改善微生物学结果和缓解临床状况,而对死亡率没有任何显著影响。
实际MIC认为是为了定义有记录的感染的治疗范围。样本流转时间仍然是使用MIC数据的主要问题。在感染早期阶段需要考虑替代方案,此时病原体的MIC尚不清楚。基于当地微生物学和“最坏情况下的MIC”的流行病学临界值(epidemiological cut-off,ECOFF),是这种情况下最常用的替代方法。“最坏情况MIC”指的是考虑抗生素覆盖敏感病原体的最高MIC。然而与实际MICs相比,这些方法低估了达到目标的概率。值得注意的是,即使是标准化方法也接受2对数级1-2倍稀释的标准差,导致PK/PD目标实现的可变性。通过比较这些替代方案,Smekal等人发现ECOFF MIC是最合适的替代方案。快速诊断和抗菌药物快速敏感性测试可能有助于减少未来的流转时间,并可能有助于更好地制定抗菌药物治疗方案。
增加负荷剂量
任何延迟开始合理的抗生素治疗,都会恶化脓毒症患者的预后,因此在脓毒症治疗的早期阶段需要达到足够的药物浓度。然而,经验性标准给药方案导致不同类别抗生素的亚治疗浓度。由于抗生素Vd经常增加,亲水抗菌素(如β-乳酰胺、万古霉素、氨基糖苷类和粘菌素)需要更高的负载剂量,以达到接近和足够的治疗浓度。新的最优β-内酰胺负荷剂量建议(3小时8g哌拉西林,3小时4g头孢他啶和0.5小时2g头孢吡肟)基于人口PK分析和Monte Carlo模型(广泛流行的抗生素优化给药方案)。同样,万古霉素、氨基糖苷类和粘菌素的负荷剂量更高;这种方法得到了临床验证研究结果的支持,该研究显示这三种抗生素的PK/PD目标达成情况都有所改善。值得注意的是,对于肾功能损害或接受RRT治疗的患者,不应改变负荷剂量。给药列线图的发展可能有助于临床医生根据总体重和肾脏CL更好地调整某些抗生素(如氨基糖苷类抗生素)的初始剂量。
抗生素的最佳给药方式
连续输注模式
内酰胺抗生素传统上是间歇性输注的。然而,越来越多的研究表明,持续注射可能在特定的临床情况下更有效。评估持续使用β-内酰胺抗生素的研究显示可改善结局,包括更高的PK/PD目标实现率,更高的临床缓解率和优越的微生物消除能力。然而3项纳入RCT的荟萃分析,并没有证明持续注射β-内酰胺抗生素在生存率方面优于间歇给药;值得注意的是,迄今为止的研究规模较小,力度不足,即使是汇总研究也是如此。最近一项来自多中心RCT个体患者数据的荟萃分析,比较了连续和间歇输注β-内酰胺抗生素,发现连续输注组的医院死亡率(第30天审查)低于间歇输注组(19.6% vs.26.3%;RR=0.74;95%置信区间[CI]:0.56-1.00,P=0.045)。最近一项RCT比较了607名危重患者连续和间歇注射美罗培南的结果,发现第28天全因死亡率和出现广泛耐药菌方面没有显著差异。BLING III试验比较了7000名患者连续和间歇输注β-内酰胺抗生素的结果,并将提供关于给药模式对临床结果影响的进一步信息。非β-内酰胺抗生素的好处也纳入研究。在此背景下,观察性研究表明,在ARC患者、肥胖患者和MIC值升高的患者(2-4 mg/L)中,连续注射利奈唑胺达到了PK/PD目标(AUC 24/MIC >80和%T > MIC >85%)。持续输注利奈唑胺,能改善肺泡弥散和临床结局。然而,目前还缺乏比较两种给药模式的RCT研究。
吸入性抗生素
吸入性抗生素已成为治疗肺部感染的一种潜在手段,同时限制了多重耐药(MDR)菌株的出现。高剂量的吸入抗生素需要到达受感染的肺实质,以优化结果。因此,需要短效镇静的网状喷雾器和特定呼吸机设置,以优化肺沉积和防止患者-呼吸机不同步。有荟萃分析评估吸入性抗生素的临床益处,该分析包括8项观察性研究和随机对照试验。接受吸入抗生素治疗的患者临床恢复率(RR:1.21, 95% CI:1.09-1.34;P=0.001)和微生物根除率(RR:1.42, 95% CI:1.22-1.650;P <0.0001),在死亡率或肾毒性风险方面没有差异。最近的两项随机对照试验,即INHALE和VAPORISE试验,评估了吸入抗生素(氨基糖苷类和磷霉素)作为辅助治疗的有效性,未能证明在治疗革兰阴性菌(GNB)相关VAP方面比标准静脉给药有任何好处。这些试验主要评估吸入性抗生素作为辅助治疗和非替代治疗的使用。然而,在MDR-GNB引起的VAP患者中,没有人将吸入多粘菌素与新的静脉注射头孢菌素/β-内酰胺酶抑制剂抗生素进行比较。另一种策略依赖使用吸入性抗生素来预防,而不是治疗VAP。在这一背景下,最近发表的一项随机对照试验评估了3天疗程的吸入阿米卡星(20 mg/kg理想体重)在预防VAP方面的益处,该研究表明,首次VAP的发生显著减少(阿米卡星组为15%,安慰剂组为22%,P=0.004)。
治疗性药物监测(TDM)和给药软件
在临床实践中,患者间药物反应性的差异是个重要挑战,识别最有可能获益和发生不良反应的人群变得相当复杂。在确定“最佳剂量”之前,可能需要测试不同的剂量。然而,这种方法很耗时,偶尔可能会让医疗人员感到沮丧。过去几十年里,出现了各种策略来应对这些挑战。最初,用药列线图和TDM是作为优化药物剂量的开创性解决方案而引入的。模型引导精准用药(model-informed precision dosing,MIPD)的概念是最近发展起来的创新方法。
最近3篇叙述性综述和1项系统综述和荟萃分析评估了β-内酰胺抗生素TDM治疗危重患者的疗效。其中两篇综述主要关注了TDM对临床结果的影响,特别强调了死亡率和抗菌素耐药性。值得注意的是,这些综述都没有发现β-内酰胺类抗生素TDM治疗与死亡率或抗菌素耐药性发展之间的显著关联。然而,值得注意的是,某些被列为重要甚至严重的偏倚风险,可能影响了研究结果。这种偏倚主要与不遵守TDM建议、偏离预期干预和混淆有关。此外,这些综述均缺乏前瞻性随机对照试验,且主要关注特殊人群(肾功能正常的脓毒症、烧伤和中性粒细胞减少患者)。值得注意的是,接受RRT治疗和那些出现ARC的患者不包括在内,这两个因素都与不合理的β-内酰胺暴露有相当大的关联。
在最近的随机对照试验中,Hagel等纳入来自多个中心的大量sCle(n=249)。本研究仅关注哌拉西林的经验性治疗,PK/PD靶点基于铜绿假单胞菌的MIC。主要结果,即TDM和非TDM组的SOFA评分无显著性差异(P=0.39)。虽然TDM降低了4.2%的死亡率,并提供了更高的微生物学和临床缓解率,但这些差异没有统计学意义。TDM能更好地实现目标浓度,减少剂量不足风险。然而,只有不到50%的患者在前5天内达到了最佳目标(没有过量用药),并在第一天出现了最低值。该研究的作者将缺乏死亡获益归因于高PK/PD靶点(特别是在第一天),这是基于铜绿假单胞菌相对较高的MIC(16 mg/L)。然而,由于大多数已鉴定的细菌的MIC值较低,未能达到目标并不会导致不良结果。很少有研究将先验PK/PD目标的设置(基于高MIC的最坏情况,主要用于经验性治疗)与细菌鉴定后确定的后验MIC进行比较。在他们的研究中,Leon等人表明,在腹腔内感染的危重患者之前(33%)和细菌记录之后(71%),PK/PD目标达到程度均有所增加。这突出了MIC选择在定义治疗的PK/PD靶点方面的关键作用。临床研究和日常实践之间的一个显著区别是获得TDM结果的延迟,这通常可以在临床研究中的样本收集后的几个小时内获得。然而,最近一项关于现实世界医疗保健环境中TDM实践的调查表明,响应时间的延迟是一个重大障碍,并确定它是有效实施TDM的主要障碍。该调查还确定,对TDM结果的解释是第二个主要挑战,特别是在非专业科室。需要优先考虑两个因素,以减少临床研究结果和日常临床实践之间的差异,这些因素包括减少TDM结果的流转时间和改善对结果解释的支持。
监测抗生素的副作用
越来越多的证据强调β-内酰胺类抗生素具有潜在的显著毒性,特别是对特定人群,如ICU患者。TDM是必要的,以减少β-内酰胺过度暴露的风险,从而减少毒性。考虑到剂量依赖的β-内酰胺的毒性阈值通常较高,该方法允许最初经验使用较高的剂量,然后根据TDM进行修正。最近研究表明,TDM在减少非β-内酰胺抗菌药物相关毒性方面有关键作用。在一项包括93例患者的回顾性研究中,基于TDM的高剂量没有导致美罗培南或哌拉西林-他唑巴坦的药物毒性;尽管高剂量组的平均日剂量高出40%以上,仍观察到这一点。由于缺乏明确的β-内酰胺毒性阈值,基于TDM调整剂量以限制毒性,是一个重要挑战。因此,迫切需要努力确定毒性动力学目标。在此背景下,一些研究集中在ICUβ-内酰胺浓度和神经毒性之间的关系。例如,一项研究发现,在50%的患者中,头孢吡肟谷浓度超过22 mg/L时(通过间歇输注)或35 mg/L以上的稳定浓度(持续输注)与神经毒性相关。美罗培南的谷浓度超过64 mg/L,氟氯西林为125mg/L,哌拉西林为360 mg/L(当不与他唑巴坦一起使用时)也有类似风险。此外,哌拉西林血浆稳定浓度超过157 mg/L(与他唑巴坦联合使用时)可以预测ICU患者的神经系统疾病,特异性为97%,敏感性为52%。值得注意的是,一项研究发现,按欧洲抗微生物药敏试验委员会(EUCAST)临床折点标准化的铜绿假单胞菌最低游离浓度(即fCmin/铜绿假单胞菌MIC比值)超过8的情况下,ICU大约一半应用哌拉西林/他唑巴坦和三分之二应用美罗培南的患者表现出明显的神经功能恶化。一项正在进行的前瞻性临床试验,即最佳TDM研究(NCT03790631),旨在建立头孢吡肟、亚胺培南、美罗培南、哌拉西林、氟氯西林、阿莫西林和头孢他啶的毒性阈值。然而,TDM指导下的给药调整方案,对预防β-内酰胺毒性和改善临床结果的潜在影响仍有待确定。
危重病患者的新旧抗生素
重新定位旧抗生素
人们对旧的抗生素重新产生了兴趣,以解决细菌对常用抗菌药物增加的耐药性(表1)。由于一些旧的抗生素在体外对MDR细菌具有抑制活性,这些药物可能是治疗这些感染的另一种方法。然而,说明书中描述的临床适应症和用药建议尚未修改,可能不适用于危重患者。
粘菌素
目前,全世界使用不同的配方和惯例来描述多粘菌素的剂量(国际单位或mg),导致临床中的最佳使用量的一些不确定性。与多粘菌素B不同,粘菌素是静脉注射的,因为无活性的粘菌素前体甲磺酸钠(CMS)在转化为粘菌素之前可转化为各种衍生物。与多粘菌素b相比,达到治疗性血浆粘菌素浓度的时间更长。研究发现粘菌素PK的个体间和个体内差异很高,导致相同给药方案后血浆浓度明显异质性。
因此,国际共识指南提供了治疗建议,以指导多粘菌素的最佳临床使用方法。最近的一项系统综述,包括了粘菌素的人群PK研究和前瞻性临床试验,也强调了基于药物狭窄的治疗指数和广泛的个体间差异,对危重患者进行个体化给药方案和TDM的必要性、异质性。建议CMS负荷剂量为9 MIU (300 mg粘菌素碱活性超过0.5-1小时),然后在12-24小时后给予第一次MD。国际共识建议根据肾功能和TDM对MD进行调整。值得注意的是,当CrCl值为120 mL/min、50 mL/min和25 mL/min时,CMS部分转化为粘菌素的比例分别增加了33%、50%和67%,导致肾功能受损患者的粘菌素浓度较高。TDM并不广泛用于粘菌素,因为需要采取预防措施,以确保样本的收集、处理和分析,以最大限度地减少CMS向粘菌素的体外转化。危重患者CMS和粘菌素TDM的初步数据显示,CMS和粘菌素浓度之间的相关性较差;也表明在给药期间存在剂量不足和过量的风险。无TDM的重症患者使用粘菌素可能是不安全的(特别是感染的病原体高MIC值和肾功能正常的患者)。
磷霉素
磷霉素组合的重新利用(基于其对MDR肠杆菌和非发酵GNB的活性)是解决抗菌素耐药性威胁的一个重要策略。磷霉素是一种亲水药物,具有低蛋白结合力、低分子量和组织广泛渗透性。不同的静脉注射配方,磷霉素二钠在美国以外的几个国家使用。然而,一些人群PK研究显示了相当大的个体内部和个体间差异性;应用标准剂量时,危重患者暴露于不合理的血浆浓度下。对MDR病原体的实验和体外研究已经确定了24小时血浆药物浓度-时间曲线下面积(AUC 0-24/MIC)为磷霉素的最佳PK/PD指数。基于Monte Carlo模拟的结果,新的给药方案包括延长和持续给药,以实现耐碳青霉烯肠杆菌科、耐碳青霉烯铜绿假单胞菌感染和接受RRT危重患者的最佳暴露量。长时间输注也可能降低与磷霉素相关的严重低钾血症的风险。
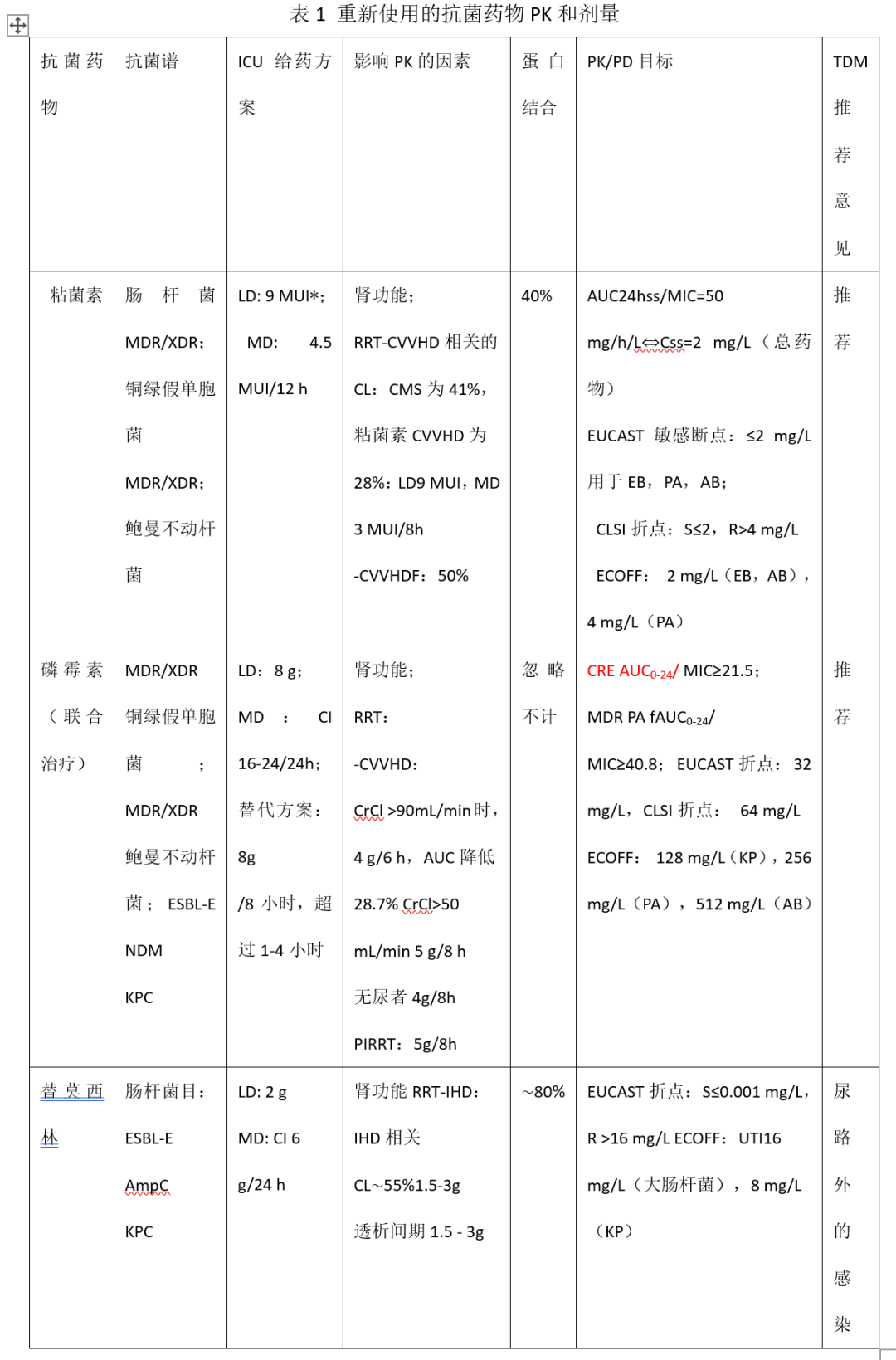
∗100万IU对应于∼33mgCBA和∼80mg的化学CMS。
AB:鲍曼不动杆菌;AmpC:AmpC头孢菌素酶;AUC:曲线下面积;CI:置信区间CL清除CLSI:临床实验室标准研究所CMS:粘菌素甲磺酸钠CrCl:肌酐清除Css:稳定浓度CVVHD:持续静脉血液透析;CVVHDF:连续静脉血液透析过滤;大肠杆菌:大肠杆菌;EB:肠杆菌;ECOFF:流行病学截止;ESBL-E:广谱乙酰胺酶;EUCAST:欧洲抗菌药物敏感性试验委员会;重症监护室:重症监护病房;IHD:间歇性血液透析;KP:肺炎克雷伯菌;肺炎克雷伯菌碳青霉烯酶产生肠杆菌;LD:加载剂量;维持剂量;MDR:耐多药;麦克风:最低抑制浓度;NDM:新德里金属乙酰胺内酰胺酶;PA:铜绿假单胞菌帕金森病药效学;PIRRT:长期间歇性肾脏替代治疗;动力学:药代动力学;RRT:肾脏替代疗法;TDM:治疗性药物监测;UTI:尿路感染;XDR:广泛耐药性。
替莫西林
替莫西林是替卡西林的6-a甲氧基衍生物,是一种古老的抗生素,在欧洲不同国家(包括英国、比利时、卢森堡和法国)用于尿路、血液和下呼吸道感染。它的使用受到了与临床折点和最佳治疗方案相关问题的限制。EUCAST最近专门定义了尿路感染(UTI)的临床折点(S≤0.001,R>16 mg/L);由于缺乏临床和PK数据,其他感染部位排除在其建议之外。
尽管有这些限制,但在过去几年中,由于其对肠杆菌的作用,包括细菌对ESBL、AmpC和产生kpc的肠杆菌的活性,人们的兴趣重新出现了。
现有危重症患者的PK数据显示,在不同的感染部位中,每天连续输注6g(在2g负荷剂量后),具有较高的个体间差异和疗效。对重症肺炎使用替莫西林(血浆和肺泡内液)进行的人群PK分析显示,肺穿透率为0.73;持续注射替莫西林也可达到更高的目标。然而在每日6g方案中,血浆和肺泡内液的折点为2 mg/L,连续输液为4 mg/L,这些值远低于8 mg/L的折点,这已用于全身感染。在腹腔内感染中,人群PK分析显示,腹水和肾功能保留的患者存在剂量不足的风险。在该人群中可能需要更高的剂量(连续注射8 g/天)来达到PK/PD目标;然而,这些病例需要可靠的临床数据。对于接受RRT的危重患者也需要。调整药物剂量,对于泌尿路以外部位的严重感染,需要谨慎使用泰莫西林。此外,应考虑MIC测定和TDM,以确保危重患者的最佳替莫西林暴露剂量。
新型抗生素
在过去的十年中,已经开发出了新的抗菌素药物,以解决耐药性的威胁,主要包括β-内酰胺和β-内酰胺酶抑制剂的组合。
需要深入了解每种药物的微生物活性谱、PK/PD特性和每种药物的临床研究结果。最近发表的几篇评论已经讨论了这些问题。表2总结了在危重症患者中使用的新型抗菌素的结果。

展望与结论
由于危重症患者的PK存在相当大且经常不可预测的异质性,因此在这一人群中采用个性化的抗菌药物给药方法是必要的。尽管TDM对于根据患者个人情况进行精确的剂量调整有价值,但大多数抗菌药物并不普遍适用。此外,TDM没有为初始经验给药提供指导,显著影响了关键结局(如脓毒性休克病例的死亡率)。因此,临床医生需要预测药物的分布模式和在感染部位达到足够药物浓度的可能性,这给临床带来了一个特殊的挑战。临床预测是基于患者的生理特征、基础疾病、药物理化性质以及所使用的任何体外治疗之间复杂的相互作用(图1)。
目前正在研究几种方法,以便更好地调整危重症患者的抗菌药物剂量。在脓毒症早期阶段,快速测定病原体药敏和MIC,通过快速诊断,可以迅速告知临床医生,在出现耐药菌株时需要更高剂量。MIPD最近已成为一种优化危重症患者抗菌药物剂量的方法,目的是通过个体疗效和毒性之间的最佳平衡来改善治疗结果,该方法涉及到数学和统计算法,同时整合患者的协变量(即先验预测)和单个药物浓度测量(即后验预测或贝叶斯预测)。虽然这些模型使用通常认为是复杂的,但可以通过软件工具集成到临床实践中。除了支持临床决策(关于治疗个体化)外,还可能利于床边实施。初步研究表明,基于MIPD框架下的万古霉素剂量,有助于降低万古霉素相关肾毒性的发生,是一种经济有效的预防肾损伤患者肾毒性的方法。总之,需要精心设计的前瞻性临床试验来确定β-乳酰胺精确给药的益处。


