European Radiology:利用深度学习放射组学模型诊断和预测早期AD疾病谱系的进展
时间:2024-11-14 19:01:10 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是最常见的神经退行性疾病,其主要特征是病理蛋白的异常积累,包括β-淀粉样蛋白和tau-神经原纤维缠结,导致随后的神经变性。阿尔茨海默病的临床谱系主要包括阿尔茨海默病引起的轻度认知障碍(MCI)和阿尔茨海默病痴呆。由于阿尔茨海默病具有不可逆的先天性特征、微妙而渐进的性质以及多种亚型的存在,早期识别阿尔茨海默病的临床谱系至关重要。尽管目前的临床和研究工作都集中在MCI作为AD的前兆,但MCI的神经病理学基础是多种多样的,一些MCI患者保持稳定(sMCI)甚至恢复正常状态,而另一些MCI患者进展为AD (pMCI)。因此,识别生物标志物和开发涵盖AD全谱的预测模型并预测从MCI到AD痴呆的进展具有巨大的临床意义。
正电子发射断层扫描(PET)是一种无创神经成像技术,通过实时可视化和各种分子相关性,在跟踪AD脑内病理生理变化方面发挥着关键作用。在一系列可用的PET示踪剂中,18F-氟脱氧葡萄糖([18F]FDG) PET已成为临床的动力,其效用超过了磁共振成像(MRI),因为其具有早期检测神经退行性异常的潜力,并且对新开发的淀粉样蛋白和tau-PET具有优越的可及性。与淀粉样蛋白-PET或tau-PET配体等其他成像标记物相比[18F], FDG是全球范围内使用最广泛的PET配体,可用于任何提供PET检查的机构。[18F]FDG PET成像在区分AD临床谱的各个阶段,以及区分sMCI和pMCI方面的临床诊断价值已被证实。值得注意的是,人工智能的出现导致了放射组学的广泛应用。深度学习(Deep learning,DL)方法在该领域也具有显著优势。此外,有效和高效地整合不同的临床、影像学和分子谱数据往往也是了解复杂疾病并做出准确诊断以确定最佳治疗的必要条件。然而,这两种模式都有其独特的优点和缺点。放射组学方法可以提取可解释的图像标记;然而,它们需要先验知识和手动编码来定义感兴趣区域(ROI)和特征提取。相比之下,深度学习方法在实现高分类和预测精度方面表现出色,但它们的复杂性往往使其难以解释。随着深度学习模型变得更加复杂,它们的可解释性显著降低。然而,分析AD的发展模式不仅需要具有强大泛化能力的模型,还需要有效的解释技术。因此,迫切需要一种替代方法来弥合可解释性和可重复性之间的差距,以平衡这两个相互冲突的需求。

最近,发表在European Radiology 上的一篇文章提出了一种基于[18F]FDG PET图像的可解释深度学习放射组学(IDLR)模型,用于诊断阿尔茨海默病(AD)的临床疾病谱,并预测从轻度认知障碍(MCI)到AD的进展。
本项多中心研究包括来自两个不同种族的独立队列的1962名受试者(来自ADNI的高加索队列和来自中国两家医院合并的亚洲队列)。IDLR模型包括特征提取、特征选择和分类/预测。研究评估了IDLR模型区分具有不同认知状态和MCI轨迹(sMCI和pMCI)的受试者的能力,并将结果与放射学和深度学习(DL)模型进行了比较。Cox模型测试了IDLR特征对MCI到AD进展的预测能力。相关性分析确定了IDLR的关键特征,并验证了它们的临床诊断价值。
IDLR模型对不同认知状态和不同轨迹MCI患者的分类效果最好,准确率为76.51%[72.88%,79.60%](95%置信区间CI),而放射组模型和DL模型的分类准确率分别为69.13%[66.28%,73.12%]和73.89%[68.99%,77.89%]。根据Cox模型,IDLR模型的风险比(HR)为1.465 (95% CI: 1.236 ~ 1.737, p < 0.001)。此外,三个关键的IDLR特征在认知阶段之间存在显著差异,并与认知量表得分显著相关(p < 0.01)。
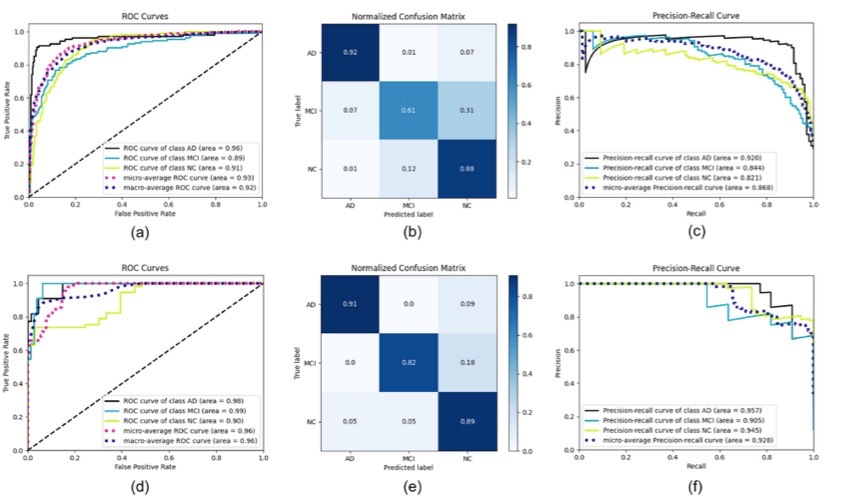
图 AUC,混淆矩阵,召回精度曲线。在队列1中,IDLR模型的三个分类性能包括AUC、混淆矩阵和召回精度曲线。d-f队列3中IDLR模型的三个分类性能包括AUC、混淆矩阵和召回精度曲线
本项研究结果表明,基于[18F]FDG PET图像的IDLR模型提高了AD临床谱诊断的准确性。
原始出处:
Jiehui Jiang,Chenyang Li,Jiaying Lu,et al.Using interpretable deep learning radiomics model to diagnose and predict progression of early AD disease spectrum: a preliminary [18F]FDG PET study.DOI:10.1007/s00330-024-11158-9


