肺癌七线治疗 3年+生存期 | MDT病例分享
时间:2024-10-05 17:00:41 热度:37.1℃ 作者:网络
01病例介绍
患者:男性,41 岁
就诊时间:2021 年02 月
主诉:确诊左肺上叶腺癌7天
既往史:体检发现轻度脂肪肝病史5年,2021年体检复查正常,2004年右腿骨折术后。
个人史/婚育史/家族史/过敏史:否认吸烟史,否认粉尘接触史。曾祖父食管癌,母亲子宫内膜癌。
体格检查:生命体征平稳,BP:128/79mmHg,H:171cm,W:64Kg,SPO2 99%;ECOG评分:0分,NRS评分:0分;余查体无异常。
影像学检查
2021-01-26 胸部CT (北大一院):左肺下舌段实性结节,大小约2.0*1.5cm,可见毛刺、分叶、胸膜牵拉表现,临近胸膜不规则增厚,左侧少量胸腔积液。
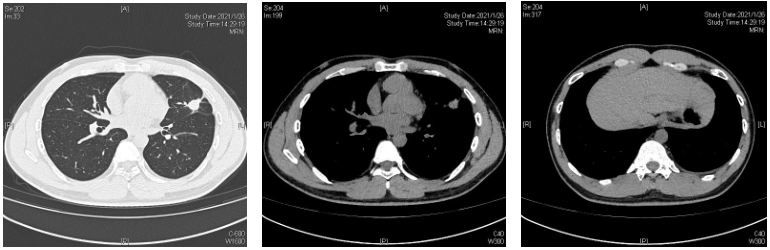
2021-02-02 CT引导下经皮肺穿刺(北大一院),术后气胸,予以胸腔闭式引流后逐渐缓解。北大一院病理:(左肺上叶)见腺癌浸润,腺泡型为主,局灶乳头状;IHC:TTF-1 (+)、NapsinA (+)、CK7 (+)、CK20 (-)、ALK(-)。诊断:肺浸润性腺癌。
2021-02-07 PET-CT(北大一院):左肺上叶实性结节(1.7*1.9*1.4cm),SUVmax4.3,邻近胸膜粘连;邻近左侧斜裂胸膜不均匀增厚,局部呈结节状,未见明显代谢升高,考虑转移可能;左侧少量胸腔积液,癌性可能性大;左侧气胸;纵隔多发小淋巴结,未见代谢升高;未见颅脑、肝脏、肾上腺、骨骼等远处转移。
第一次院内MDT
2021-02-09 治疗建议:明确肿瘤分期,切除病灶。
2021-02-10 行左肺上叶舌段楔形切除术+胸膜病变活检切除术,术中探查:左侧胸腔少量血性胸水,左肺上叶舌段结节,局部胸膜牵拉,脏层胸膜、壁层胸膜、膈肌表面多发质硬白色结节。术后病理:(左肺上叶结节)肺浸润性腺癌,大小1*1.7*1.5cm,乳头及微乳头型为主(70%),部分腺泡型(30%),侵透肺膜,可见气道播散,局灶见沙砾体样钙化,未见明确脉管内癌栓及神经侵犯。周围肺组织支气管周围少许碳沫沉积,切缘肺膜下局灶可见癌浸润。免疫组化:TTF-1 (+),CK7 (+),NapsinA(+),CK5/6(局灶+),P63 (局灶+),EMA (+),Ki-67 (40%+)。(脏层胸膜)肺浸润性腺癌;(胸壁2个结节)肺浸润性腺癌;(胸腔积液)大量散在及灶状分布腺癌细胞;(胸腔灌洗液)散在及灶状分布的肿瘤细胞。术后组织标本基因检测:EGFR 19del 突变(p.E746_A750del,25.7%),TP53 基因突变(31.6%), PTEN基因失活突变(1.4%);PD-L1 (22C3):TPS<1%,CPS =12;TMB-L (19muts); MSS。
2022-02-11 (术后 1 年)外周血 ctDNA 阳性
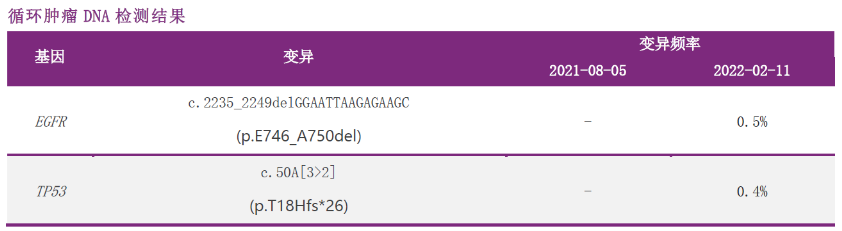
疗效评价-PD
一线治疗:2021-03-16至2022-04-11口服奥希替尼80mg qd。
一线PFS:13个月。
患者诊断:左肺上叶腺癌( pT4NxM1a IVA 期, EGFR 19del 突变),脏层胸膜转移,壁层胸膜转移,恶性胸腔积液,左肺上叶结节姑息性切除术后。
治疗建议:停奥希替尼,完善相关检查。
2022-04-11 胸部 CT :左侧心膈角新发结节(大小约 2.5*1.2cm ),左侧胸腔积液,胸膜不规则增厚。
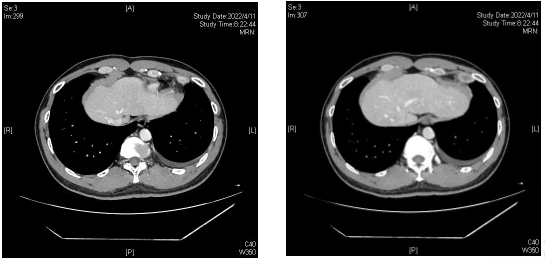
2022-04-14 超声探查,右侧胸部第4、5肋间,锁骨中线内侧壁层胸膜外可见一椭圆形低回声结节,大小约2.0cmx1.7cm,内见皮髓质结构,未见血流信号。
2022-04-14 超声引导下穿刺,组织病理:(胸膜结节,肿大淋巴结可能)肿瘤细胞呈巢片样、梁状排列,细胞胞浆稀少,核梭形及卵圆形、欠规则。免疫组化:TTF-1(+)、CgA(+)、Syn(+)、Napsin A(-)、CK7(部分+)、CK20(-)、 P40(-)、CK5+6(-)、Ki67(80%+)。综上,符合小细胞癌。
2022-04-15 行第2次(奥希替尼耐药后)组织及外周血NGS(吉因加):胸膜结节穿刺组织基因检测:EGFR 19del突变(p.E746_A750del,51%),TP53基因突变(76.4%),PIK3CA基因扩增(CN 1.5),EGFR基因扩增(CN 1.9),DDR2、GNAS、MDM4、NTRK1、TERT、ZNF217基因扩增,;TMB-L(0.96 muts/mb);MSS;PD-L1 TPS<1%。同期外周血基因检测:EGFR 19del(p.E746_A750del,1.7%),TP53基因突变(1.4%);HLA-I检出(免疫预后因素,提示治疗相关OS缩短);TMB-L(0%)。

患者EGFR 19del同时合并其他多种基因突变,提示治疗困难
2022-04-16 PET-CT:术区未见明确复发;左侧肋膈角区高代谢结节(2.7*1.6cm),SUVmax6.7,淋巴结转移可能性大,可疑累及临近胸膜,伴左侧胸腔积液。
疗效评价-SD
2022-04-16 二线治疗:
阿法替尼+EC方案化疗:阿法替尼 30mg qd+依托泊苷0.17g(100mg/m2)D1-3+卡铂550(AUC=5)mg /Q21d,共6周期,末次化疗日期2022-8-7;之后继续阿法替尼治疗至2022-11-01。化疗过程中I级胃肠道反应,II度骨髓抑制。
C3联合左侧肋膈角淋巴结局部放疗。
二线PFS:6个月。
2022-05-19(C2后)CT:左侧心膈角区肿大淋巴结2.3*1.2cm。评效SD。
2022-07-28(C5后)CT:原左心膈角区肿大淋巴结本次检查显示不清,局部表现为软组织略厚。
2022-08-31(C6后)CT:原左心膈角区略增厚未见显示。
2022-10-21 复查CT:左肺癌术后,双肺多发实性微结节,大部分为新出现,考虑转移。
二线治疗期间部分影像:
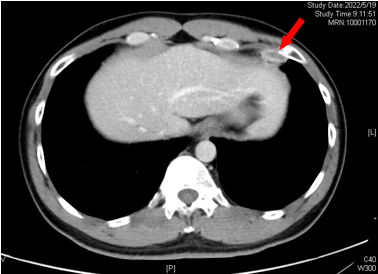
2022-05-19(C2后)
左侧心膈角区淋巴结SD
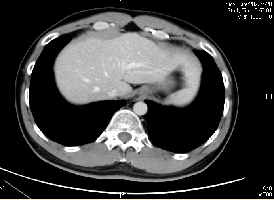
2022-07-28(C5后)
左心膈角区淋巴结显不清
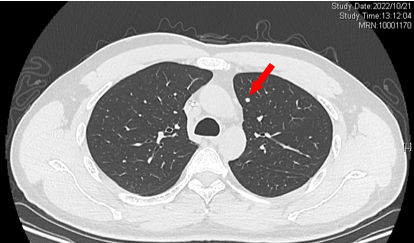
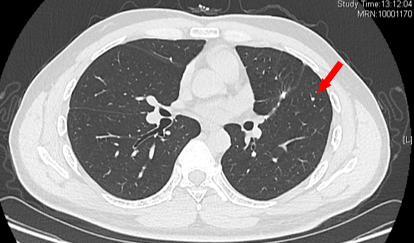
2022-10-21 双肺新发多发微结节 考虑转移
2022-10-21 行外周血NGS:EGFR 19del突变(p.E746_A750del,0.1%)。
疗效评价-PD
2022-11-01 开始三线治疗:
治疗方案:阿美替尼110mg Qd + 安罗替尼8mg d1-14/Q21d,共治疗4周期,期间评效SD,末次治疗日期2023.2.14。
2022-12-29 复查CT:左肺上叶术后改变,双肺多发微结节,较前变化不显著。
2023-02-14 复查CT:左肺上叶术后改变,双肺多发微结节,较前部分可疑略进展。
三线PFS:3.5个月。
三线治疗期间部分影像:
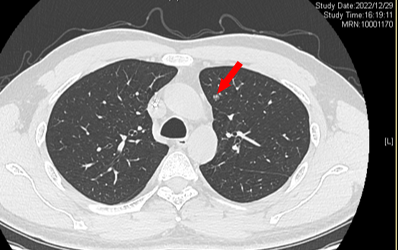
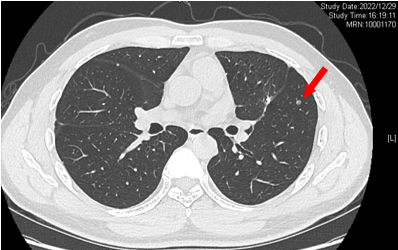
2022-12-29 变化不显著
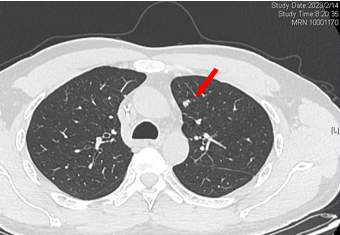
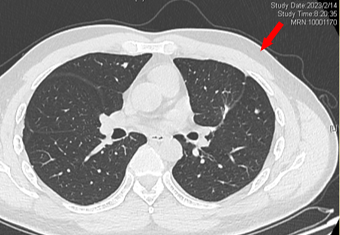
2023-02-14 较前可疑略进展
2023-02-15行外周血NGS:EGFR 19del突变(p.E746_A750del,25%),EGFR基因扩增(CN 1.5),MDM4基因扩增(CN 1.6),MYC基因扩增(CN 1.5)。
疗效评价-PD
2023-02-24 开始四线治疗:
治疗方案:伏美替尼+白蛋白紫杉醇(C1 200mg d1、d8,C2 200mg d1,C3-C6 400mg d1)+贝伐珠单抗(500mg d1),共6周期,复查新见多发骨转移,C3开始加用地舒单抗,末次化疗日期2023.06.09。
2022-04-06 复查CT(C2后):双肺多发微结节,较前部分缩小、减少。
2023-04-07 复查骨扫描(C2后):对比2022.9.16骨扫描,新见C7、T12、L1、L5、S1、双侧第5肋骨异常所见,考虑骨转移可能性大。
2023-02-24 开始四线治疗,期间随访情况:
2023-05-04 复查脑增强MRI未见转移。
2023-05-16复查CT(C4后):双肺多发微结节,较前部分略增大;左侧胸骨后、左侧腋窝淋巴结转移可能。
2023-06-09查超声:左侧腋下淋巴结形态异常;轻微脂肪肝。
2023-06-26 PET-CT:颅脑、肝脏未见转移;左侧腋窝、前纵隔淋巴结肿大,考虑转移;多发骨转移。
四线治疗部分影像展示:
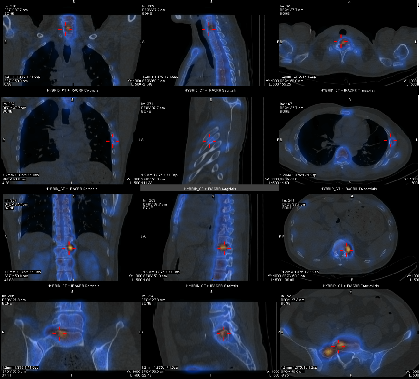
2023-04-07 骨扫描(C2后)多发骨转移可能性大
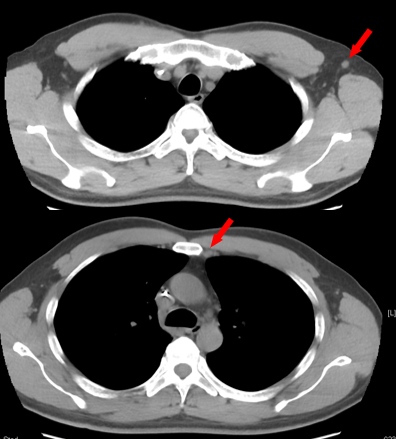
2023-05-16 胸部CT(C4后)
左侧胸骨后、左侧腋窝淋巴结转移
四线治疗期间肿标变化情况展示:
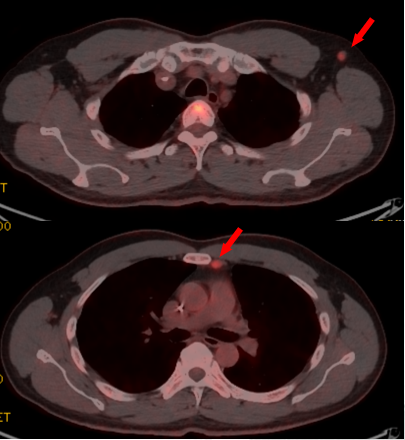
2023-07-04 行前纵隔淋巴结穿刺,病理:(前纵隔淋巴结穿刺)符合小细胞癌转移,IHC:Syn(+),CgA(+),TTF-1(+),NapsinA(-),P40(-),CK5/6(-),Ki-67(90%+)。
2023-07-06 外科予腋窝淋巴结活检:(左侧腋窝淋巴结)符合小细胞癌转移,IHC:TTF-1(+),Syn(+),CgA(+),NapsinA(-),CK5/6(0),P40(-),Ki67(80%+)。
2023-07-07 腋窝淋巴结穿刺组织基因检测结果:EGFR 19del(p.E746_A750del,64.2%)突变,TP53基因突变(87.9%),CDK12基因p.S102Dfs*23突变(5.1%),MCL1、EGFR(CN 1.8)扩增突变,PIK3R1、WRN、BRCA2(0.7%)、RAD51、FANCA缺失突变;TMB-L;MSS。
2023-07-09 外周血基因检测:EGFR 19del(p.E746_A750del,46.8%)突变,TP53基因突变(66.3%),CREBBP基因(p.I678M)突变(1.1%),EGFR基因扩增(CN1.8)。
疗效评价-PD
2023-07-18开始五线治疗:
治疗方案:鲁比卡丁(ZEPZELCA) 4mg ivgtt +伏美替尼+安罗替尼/Q21d;目前已行2周期,末次2023.08.08。
五线PFS:2个月
2023.08.04复查上腹部MRI:肝内多发异常信号,考虑转移;右肾复杂囊肿;骨转移。
2023.08.04复查脑MRI:右侧小脑、右侧半卵圆中心及左侧颞叶异常信号,结合病史,考虑转移。
五线治疗期间的影像展示:
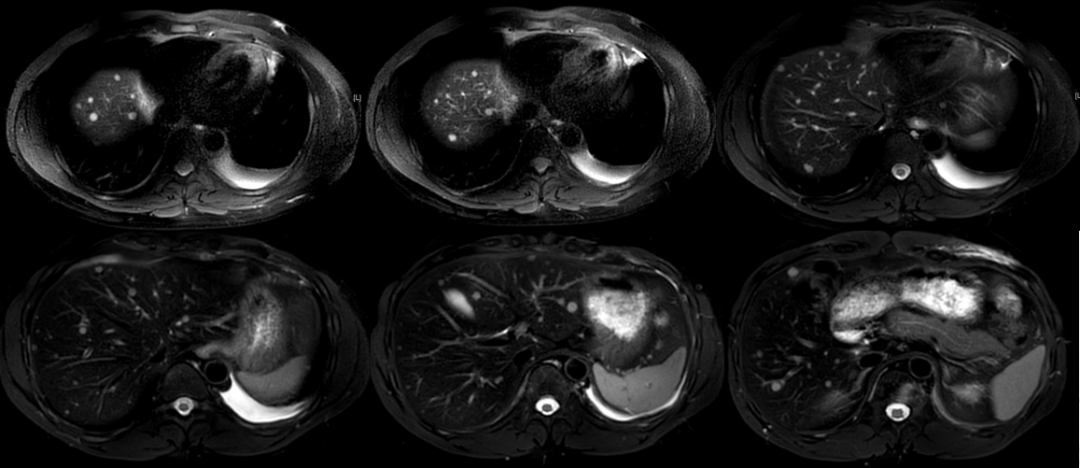
2023-07-19 胸部CT
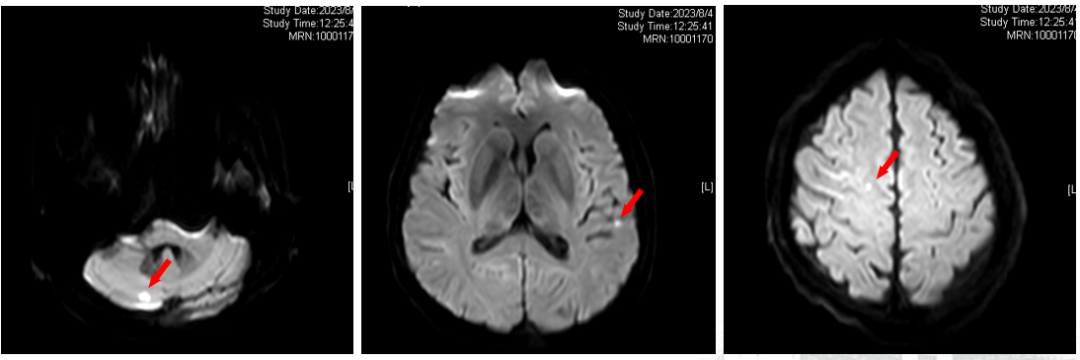
2023-8-4 MRI 脑转移
疗效评价-PD
2023-09-07开始六线治疗:
治疗方案:伏美替尼+奥拉帕利+替莫唑胺;治疗2周期后左侧大量胸腔积液,肺、肝、脑PD。
六线PFS:1.7个月
六线治疗期间的影像展示:
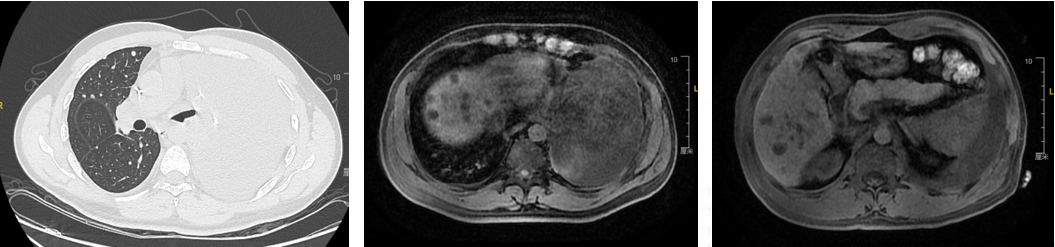
疗效评价-SD
2023-11-10开始七线治疗:
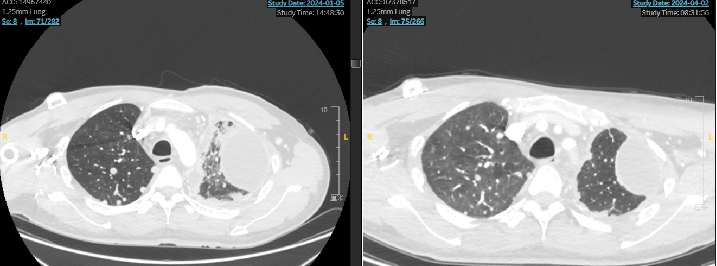
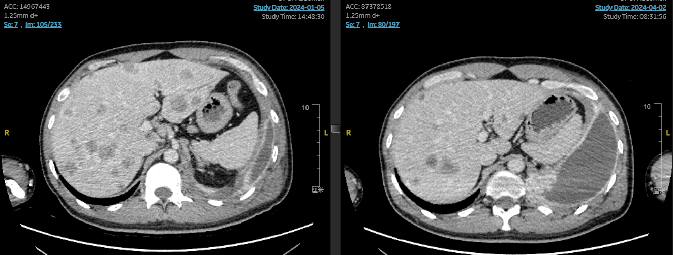
治疗方案:拓泊替康2mg D1-5+替雷利珠单抗200mg D1+贝伐珠单抗400mgD1/Q21d;治疗2周期后疗效评价SD。维持治疗4周期后替雷利珠单抗+贝伐珠单抗维持治疗至今。
七线PFS:6个月
七线治疗期间的影像展示:
整体回顾
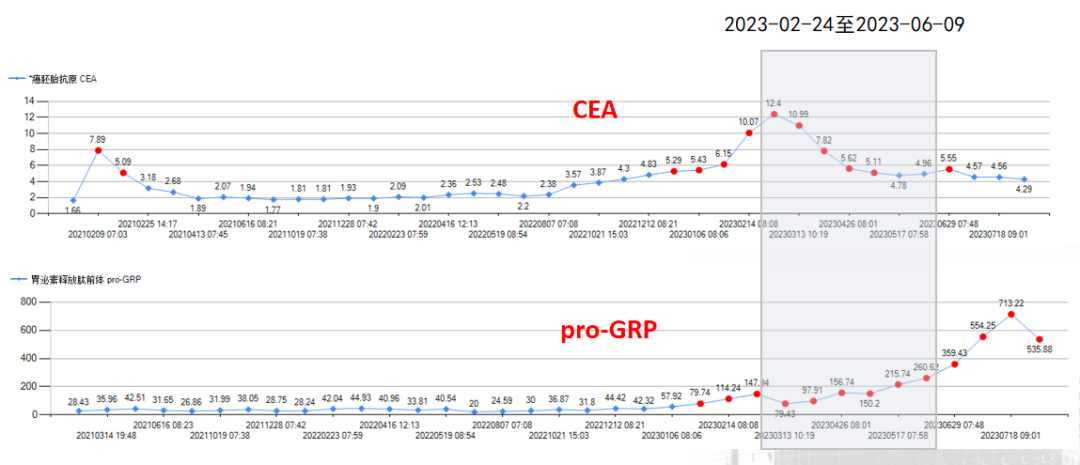
治疗经过及随访--肿标监测:
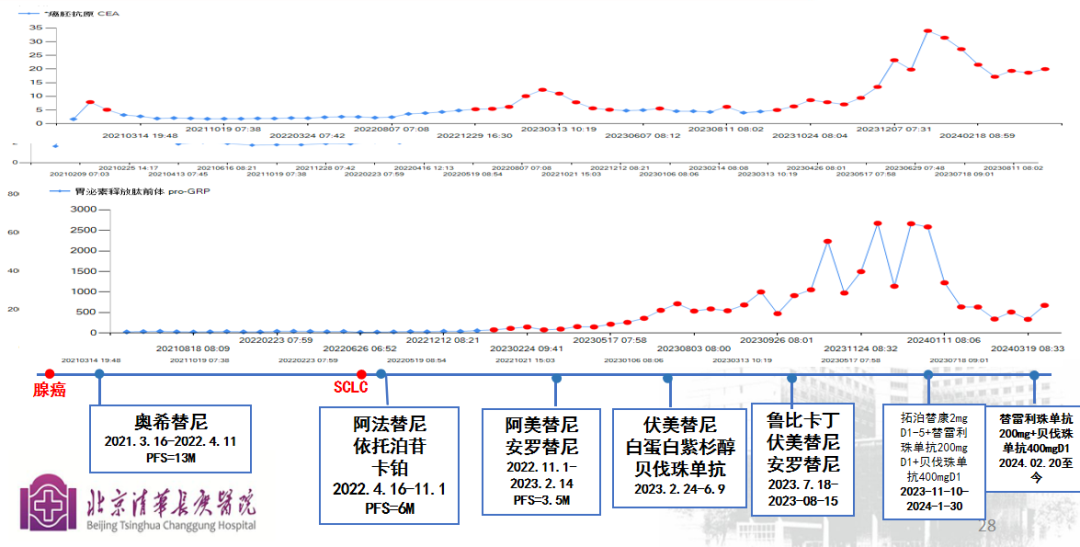
02 病例讨论
问题1:患者初诊晚期肺腺癌伴EGFR 19del(p.E746_A750del)突变,奥希替尼靶向治疗13个月出现小细胞癌转化,此后经历多线化疗、抗血管生成治疗等,EGFR敏感突变首先1+3,3+X?
北京市昌平区医院-肿瘤科-徐肖:在面对晚期肺腺癌伴EGFR突变患者的复杂病情时,我认为需要结合多方面的治疗策略。首先,对于EGFR突变的患者,一线治疗通常选择第三代EGFR酪氨酸激酶抑制剂(TKI),如奥希替尼。这个选择基于临床研究的证据,显示其在延长无进展生存期(PFS)和总生存期(OS)方面具有优势,尤其是在控制颅内病灶方面表现更佳。然而,当患者在接受奥希替尼治疗后出现小细胞癌转化时,这提示了一个更复杂的耐药机制。此时,需要重新评估患者的病理和基因检测结果,以确定下一步的治疗策略。面对这种转化,我们通常会考虑采用小细胞肺癌的治疗方案,如依托泊苷联合铂类药物的化疗。此外,抗血管生成治疗也可以作为辅助选择,以帮助抑制肿瘤的血供。在治疗过程中,如何延缓耐药的发生是一个关键问题。一些研究提示,结合化疗或抗血管生成药物可能延长PFS,但这也需要权衡患者的经济成本和药物毒性的增加。因此,在临床实践中,选择联合治疗时需要慎重考虑,并与患者充分沟通,权衡利弊。对于后续的治疗选择,当小细胞癌转化后的患者出现进展时,我们可以考虑进行更全面的基因检测,以识别可能的新靶点,如MET、HER2或KRAS突变等。如果发现新的靶点,可以尝试使用相应的靶向治疗或抗体-药物偶联物(ADC)药物。最后,患者的体能状况、经济能力以及肿瘤负荷都将影响后续治疗的选择。在多线治疗后,患者可能对强烈治疗的耐受性降低,因此选择耐受性较好的治疗手段进行维持治疗可能更为合适。
解放军总医院第八医学中心-肿瘤内科-周晶晶:对于EGFR 19del突变的小细胞癌转化病例,我们在治疗时必须非常灵活。奥希替尼的靶向治疗在这个阶段可能不再足够。1+3的组合是一个合适的策略,即将奥希替尼与抗血管生成药物或免疫治疗结合使用。3+X的组合可以更具个体化,基于患者的基因检测结果调整具体的药物选择。我们还应考虑继续使用铂类化疗,这在一些病例中显示出良好的效果。
问题2:如何看待转化性小细胞肺癌多种方案均效果不佳?
北京汇安中西医结合医院-肿瘤中心-刘涛:转化性小细胞肺癌在临床治疗中是一项非常具有挑战性的任务。这种癌症通常从其他类型的肺癌,如腺癌,经过一段时间的治疗后转化而来,尤其是在靶向药物治疗之后。这类癌症虽然发生率不高,但一旦出现,其进展速度极快,并且对许多传统治疗方案的反应不佳。几年前,由于我们对免疫治疗的认识还不够深入,患者在接受放疗后结合免疫治疗时,常常面临免疫性肺炎的风险,这给治疗带来了很大的困难。然而,随着近年来治疗手段的增加和我们临床思维的扩展,患者的生存期有望得到改善。
北京市昌平区医院-肿瘤科-徐肖:转化性小细胞肺癌治疗效果不佳,主要是因为这类癌症具有极强的异质性。转化后的小细胞癌通常更具侵袭性,且常伴随其他复杂的基因突变,如EGFR、TP53或RB1的共同突变,这使得传统的治疗方法难以产生预期的疗效。癌症的侵袭性和个体差异可能导致治疗效果不一,年轻患者的肿瘤往往更具侵袭性,预后较差。现有的治疗手段,如靶向治疗和免疫治疗,虽然在部分患者中取得了一定效果,但对转化性小细胞肺癌的整体控制依然不够理想。要克服这种困境,我们需要更深入地了解转化后的分子机制,以便找到新的靶点,开发更具针对性的药物或联合治疗方案。
解放军总医院第八医学中心-肿瘤内科-周晶晶:转化性小细胞肺癌的治疗效果不佳是一个普遍的挑战,主要原因是它的高度恶性和快速进展。这类癌症在转化后,通常对传统的治疗方式耐药,尤其是经过靶向治疗或化疗后,免疫逃逸机制也更加明显。虽然抗血管生成药物和免疫治疗在某些病例中延长了生存期,但总体疗效仍不理想。这提醒我们在治疗转化性小细胞肺癌时,应该更加注重个体化治疗,探索新型药物和治疗组合,如尝试新兴的免疫疗法或靶向药物,并同时积极进行基因监测,以便及早调整治疗策略。
问题3 :目前替雷利珠单抗 + 贝伐珠单抗维持治疗,再进展后续治疗如何选择?
北京汇安中西医结合医院-肿瘤中心-刘涛:在临床实践中,我曾处理过一个类似的病例。患者在多次使用靶向和免疫治疗后,出现了疾病进展。对此,我尝试更换不同的免疫治疗药物,结果显示仍然有效。基于这一经验,对于化疗药物已经用尽且患者整体状况不佳的情况,可以考虑更换免疫药物以观察治疗效果。当前的治疗策略仍然需要多学科团队的支持,以制定个性化的治疗方案。虽然转化性小细胞肺癌的治疗目前面临诸多挑战,但通过不断尝试新的治疗组合和策略,我们有可能为患者带来更好的预后。期待未来能够有更多的大规模临床试验和研究,以探索出更有效的治疗方案,从而进一步改善这种疾病的治疗效果。
北京昌平区医院-甲乳外科-马逦楠:通过今天的讨论可以看到多学科合作在癌症治疗中的重要性。我们必须不断学习新的治疗方法,了解最新的研究进展,以便为患者提供更为优质的治疗选择。此外,我想强调免疫治疗在小细胞肺癌中的应用潜力。尽管目前的证据有限,但对于合适的患者而言,PD-1抑制剂等药物可能提供额外的治疗选择。当然,这也取决于患者的意愿和经济能力。
北京市昌平区医院-肿瘤科-徐肖:替雷利珠单抗+贝伐珠单抗维持治疗后若发生进展,首先考虑的是继续免疫治疗,同时加入其他方案。对于PD-1抑制剂耐药的患者,可以尝试CTLA-4抑制剂如伊匹木单抗联合化疗。此外,部分患者对不同免疫药物的反应会不同,因此更换免疫检查点抑制剂也可考虑。基于患者病情的进一步基因检测可以为后续治疗提供指导,发现潜在的靶向治疗机会。同时,密切关注患者的全身状况,选择合适的治疗强度。
解放军总医院第八医学中心-肿瘤内科-周晶晶:对于替雷利珠单抗+贝伐珠单抗治疗失败后的选择,建议更早地进行基因监测,以尽早发现潜在的突变并及时调整治疗策略,建议尝试新的免疫联合治疗或靶向药物,并且在治疗过程中通过动态调整方案来应对免疫逃逸和耐药性。
03 MDT小结
患者是一位41岁男性,确诊为左肺上叶腺癌,EGFR 19del突变。初期行楔形切除术,术后奥希替尼治疗,后因耐药调整为阿法替尼联合化疗。期间多次影像学评估显示病情进展,伴多发骨及淋巴结转移。历经七线治疗,包括阿美替尼、伏美替尼及多种化疗方案,均获短暂控制。最新治疗调整为拓泊替康联合免疫及抗血管生成药物,目前病情稳定。团队建议继续密切监测,并根据疗效动态调整治疗方案。患者全程积极配合,定期随访。
管静芝 述评
——解放军总医院第八医学中心
在处理这个病例时,患者可能同时存在小细胞肺癌和腺癌,这提示需谨慎对待穿刺活检的局限性,并关注TP53和RB1基因高表达的诊断价值。鉴于小细胞肺癌的高侵袭性和快速进展,建议在早期阶段采用EP方案联合贝伐单抗和免疫治疗,以期提高治疗效果。此外,根据基因检测结果和临床表现制定个体化治疗方案至关重要,这不仅有助于提升患者的预后,还能改善其生活质量。在这个过程中,跨学科的团队协作和对最新研究进展的持续关注也同样重要,以确保为患者提供最优的治疗策略。


