震惊!芍药苷激活自噬,MAPK/mTOR通路成关键,拯救肝细胞于水火之中!
时间:2024-10-04 17:00:46 热度:37.1℃ 作者:网络
药物性肝损伤(DILI)是药物不良反应谱系中最为常见的表现形式之一。多种药物,尤其是非甾体抗炎药、抗肿瘤药物及抗菌药物,均被证实可能引发不同程度的DILI。自噬是细胞内一种重要的防御性机制,其主要功能在于清除受损的细胞器与蛋白质聚集体,借此减轻肝细胞的代谢负荷与氧化应激水平,进而捍卫其免受进一步的伤害。有研究揭示,自噬过程的抑制或可视为药物诱导肝损伤发生的一个早期潜在因素,而相应地,促进自噬活性则有望成为缓解乃至预防此类损伤的有效途径。
芍药苷(PF)是源自芍药的关键成分,药理活性广泛且显著,涵盖了抗凋亡、抗氧化及抗癌等多重特性,预示着其在多种疾病治疗中的潜在应用前景。PF在保护肝脏功能方面展现出了尤为突出的效果,被证实可用于应对肝衰竭、胆汁淤积、非酒精性脂肪肝及肝细胞癌等肝脏疾病的治疗。
近日,一篇名为“Paeoniforin protects hepatocytes from APAP-induced damage through launching autophagy via the MAPK/mTOR signaling Pathway”的文章探究了PF对于肝损伤的相关作用。

图1 论文首页
PF可减轻APAP引起的肝损伤病理变化
病理结果显示,注射APAP(对乙酰氨基酚)后,APAP组小鼠体重呈现下降趋势,且在第5天时,各组小鼠的生理状态表现出相似性(图2C)。且APAP组小鼠的肝脏指数与脾脏指数均显著上升(p<0.01),HPF与LPF组小鼠则表现出肝脏指数与脾脏指数的降低(p<0.01),提示PF可能具有缓解小鼠脾脏与肝脏肿胀的效应(图2A,B)。
同时,通过对比各组小鼠的肝功能指标,研究发现APAP组小鼠的上述指标水平较对照组明显升高,这标志着DILI模型构建成功。PF高、中剂量组小鼠的ALT、ALP、γ-GT、TBIL、AST水平显著低于APAP组(图2D-H),且LPF组(50 mg/kg)在除TBIL外的其他指标上均表现出显著的降低效果(图2G)。
此外,APAP组小鼠的肝小叶排列呈现紊乱状态,门管区周围分布着大量坏死的肝细胞,并伴有炎性因子的浸润,视野内可见广泛的灶性坏死(×100)。相比之下,MPF与HPF组小鼠的肝小叶结构清晰且排列紧密,PF组小鼠的肝组织水肿及炎性浸润得到了显著改善,尤以高剂量组效果最佳(图2J)。通过计算肝组织坏死指数,研究还发现PF治疗能够显著减轻肝损伤的程度(图2I)。综上所述,PF对肝脏具有明确的保护作用,能够有效减缓APAP诱导的肝损伤进程。
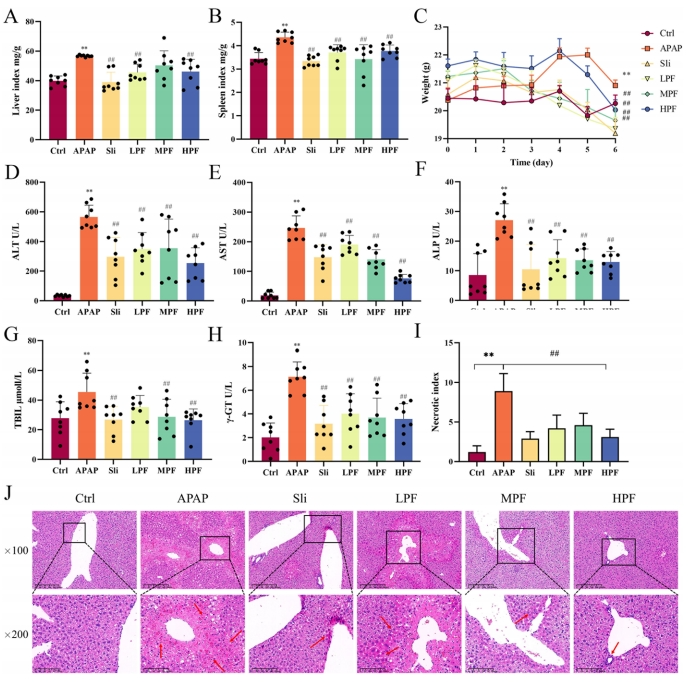
图2 PF对APAP引起小鼠的生化和病理参数变化
PF抑制ROS提高APAP模型小鼠抗氧化能力
为深入剖析PF治疗对氧化状态的调控效应,研究首先对一系列氧化应激相关指标进行了系统评估,包括GSH(谷胱甘肽)、SOD(超氧化物歧化酶)及MDA(丙二醛)的水平。结果显示,相较于对照组,APAP处理显著降低了SOD与GSH的含量,而PF的介入,尤其是在200mg/kg的浓度下,有效恢复了小鼠的抗氧化防御能力(图3A、B)。值得注意的是,MDA水平的变化趋势与GSH和SOD相反,其上升反映了机体氧化应激的加剧。然而,PF的干预显著减轻了APAP诱导的MDA水平上升及氧化损伤(图3C),进一步证实了PF在缓解氧化应激中的积极作用。
此外,研究采用免疫荧光技术直观检测了ROS的表达情况(图3E)。结果显示,MPF与HPF组中的ROS荧光强度显著低于APAP组,表明PF的高、中剂量组对肝细胞内ROS的生成具有显著的抑制作用(p<0.01)(图3D)。进一步地实验发现,APAP处理显著上调了CYP2E1的表达,而PF则有效逆转了这一现象(图3I)。同时,蛋白质印迹分析揭示了APAP诱导的CYP3A4表达上调,但200mg/kg的PF处理显著抑制了这种上调(图3G)。
透射电镜观察也揭示了APAP对线粒体及粗面内质网结构的破坏作用,而高剂量PF处理则显著改善了这些细胞器的形态结构(图3J),进一步证明了PF在抑制ROS生成、提高细胞色素P450酶活性及增强小鼠抗氧化防御能力方面的显著效果。
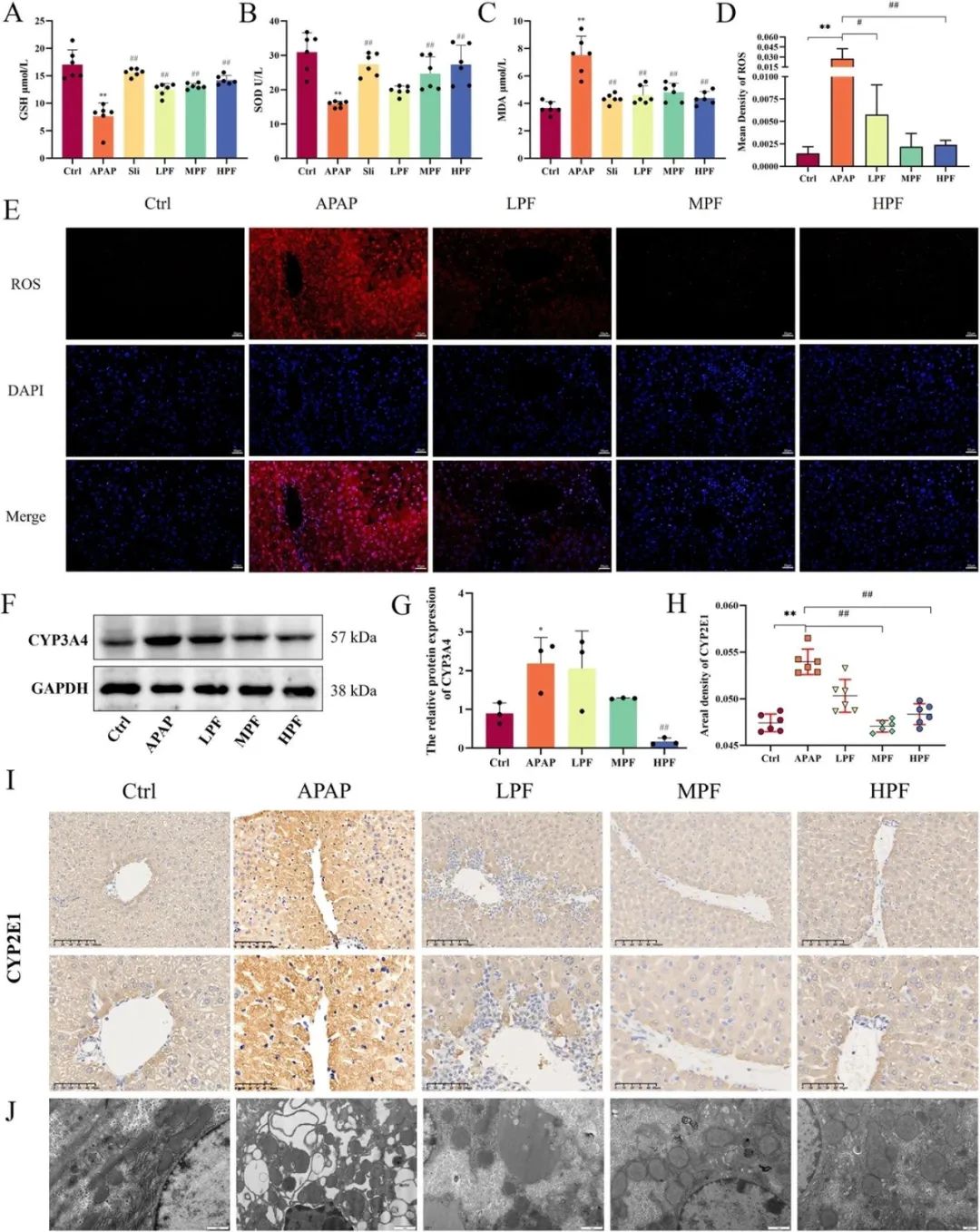
图3 PF对APAP刺激下氧化应激的影响
PF抑制APAP诱导的肝损伤中细胞凋亡的进展
TUNEL染色技术直观地反映细胞凋亡的发生情况(图4A),相较于对照组,APAP组在肝损伤区域显著聚集了凋亡阳性因子。而治疗组相较于APAP组,凋亡阳性表达率显著降低,提示PF能够改善APAP诱导的肝损伤中的细胞凋亡现象(图4D)。
为进一步验证PF在肝损伤治疗中对抗凋亡的作用,研究采用了IHC法检测凋亡特征因子的阳性表达情况。结果显示,阳性表达主要集中在肝门管区,且APAP刺激的小鼠肝脏中caspase 3的表达更为显著,这进一步证实了肝损伤过程中伴随着细胞凋亡的发生。同时,caspase 9在对照组中表达水平较低,而在APAP组中则显著升高。PF预处理能够减弱促凋亡蛋白(caspase 9和caspase 3)的阳性表达,且以200mg/kg剂量效果最为显著(图4B、C)。
此外,研究还利用Western印迹法检测了促凋亡与抗凋亡蛋白(BAD、BAX、caspase 9、caspase 3、BCL-2)的相对表达情况(图4E、F)。结果显示,BAD、BAX、caspase 9的相对蛋白表达在APAP处理后均有所升高,而PF处理后则显著降低(图4G、I、K)。特别地,caspase 3作为凋亡最敏感的指标,不同剂量的PF均能有效抑制APAP引起的其表达升高(图4L)。值得注意的是,虽然BCL-2在对照组和APAP组之间的表达水平无显著差异,但APAP组的BCL-2/BAX比值明显下降,而在PF组则显著升高(图4H、J)。结果表明,PF通过促进抗凋亡蛋白的活性并抑制促凋亡蛋白的表达来发挥抗凋亡作用。
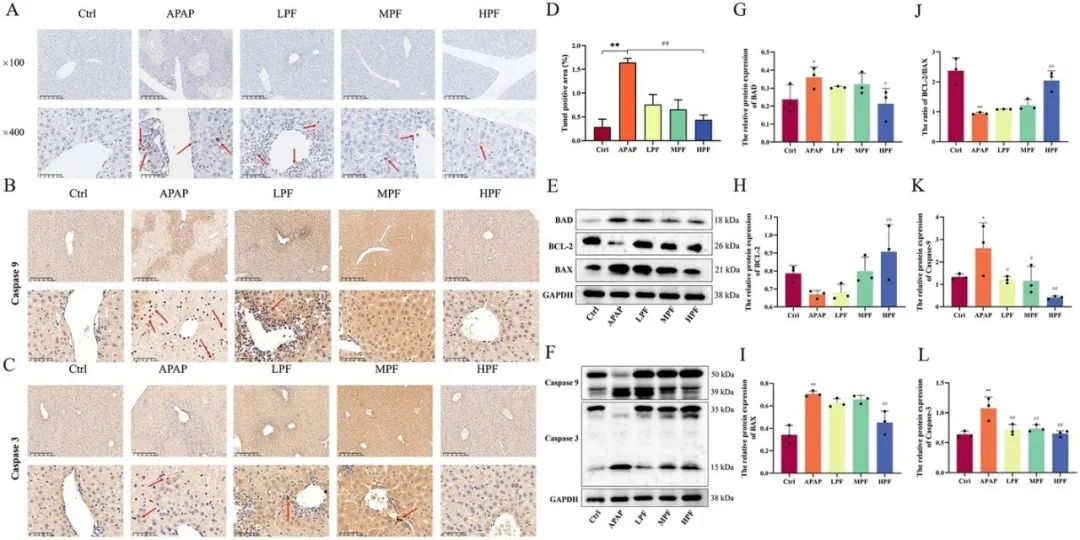
图4 PF在APAP引起的肝损伤中的抗凋亡作用
PF激活自噬保护肝脏免受APAP损伤
通过透射电子显微镜对肝组织样本进行细致分析(图5A),研究发现相较于对照组,APAP组肝细胞内粗面内质网显著扩张,且自噬体数量稀少,同时伴随肝细胞凋亡、核皱缩及染色质凝聚等病理特征。相比之下,PF组肝细胞则展现出更为丰富的自噬体数量,且细胞形态结构保持完整,染色质分布均匀。
由于自噬过程中的关键分子是LC3与p62,为此,研究采用IHC与WB技术,对LC3与p62的表达变化进行了深入探究(图5B、C)。IHC分析结果显示,PF处理显著增强了LC3的阳性表达,提示其对自噬过程具有明确的促进作用(图5D)。另一方面,APAP组p62的表达水平显著上调,而PF干预则有效逆转了这一趋势(图5E),表明PF可能通过影响p62的降解来调控自噬活动。
与IHC结果相呼应,WB分析同样揭示了MPF与HPF组p62表达水平的显著抑制。针对LC3的亚型分析则显示,APAP处理显著降低了LC3-II与LC3-I的比例,而PF干预则有效缓解了这一变化(图5F、G),进一步证实了PF在促进自噬、减轻肝损伤方面的积极作用。
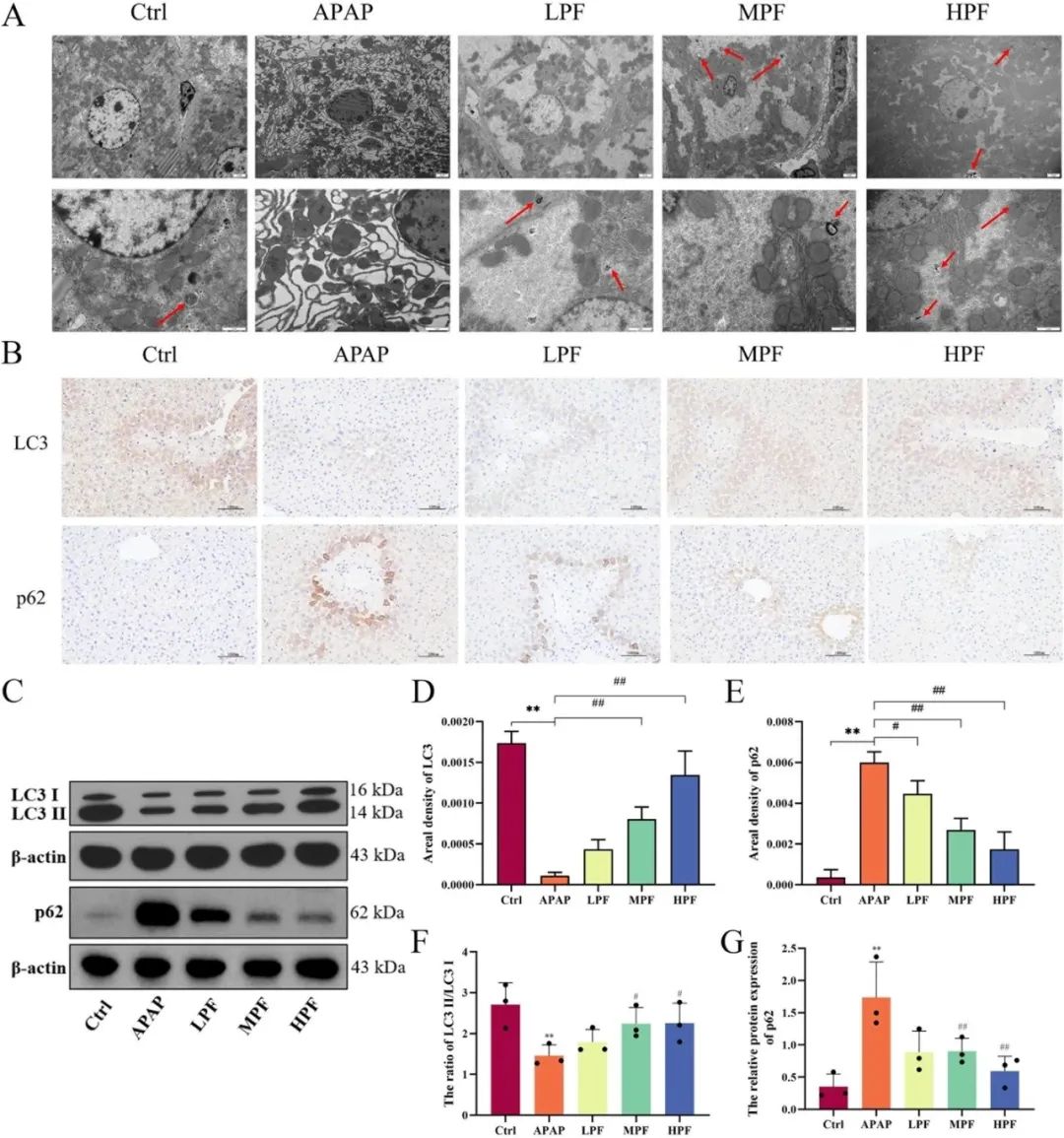
图5 PF调控自噬代表指标的变化
转录组学揭示PF对APAP诱发肝损伤的深层机制
为进一步阐明PF在抵御APAP所致肝损伤中的潜在作用机制,研究对小鼠肝脏样本实施了测序分析。结果显示,相较于对照组,APAP组中共有2444个基因表达上调,1552个基因表达下调。进一步对比发现,HPF组与APAP组之间存在508个差异性表达的基因,其中443个基因表达下调,65个基因表达上调(图6A、B)。
GSEA分析揭示了PF对多条重要信号通路及生理过程的调控作用,包括但不限于MAPK信号通路、mTOR信号通路、细胞凋亡等。结合GO分析与KEGG富集的结果,MAPK信号通路在差异基因分析中脱颖而出,其在三组对比中均呈现出较高的显著性,且表现趋势一致(图6C–F)。
综上所述,MAPK信号通路在PF对抗APAP所致DILI的过程中扮演着核心角色。该通路可能通过调控mTOR信号,进一步激活自噬机制,从而有效抑制氧化应激与细胞凋亡,展现出其在保护肝脏免受药物损伤方面的关键作用。
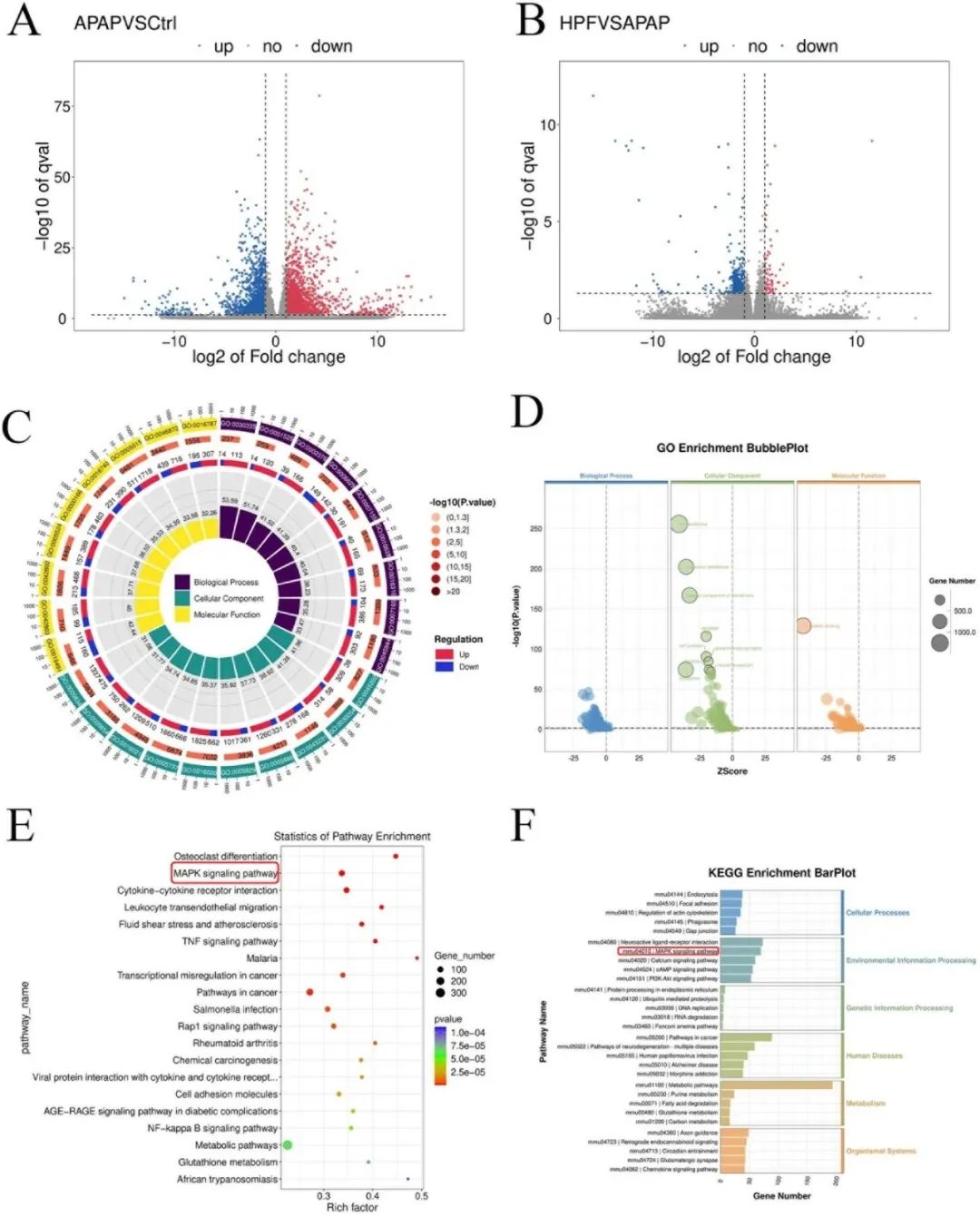
图6 PF改善APAP引起的肝损伤中的转录组分析
结论
总之,PF在抑制由APAP诱导的肝损伤过程中,起到了关键性的修复作用,有望推动PF在临床实践中的进一步发展和应用。
参考文献:
Deng X, Li Y, Chen Y, Hu Q, Zhang W, Chen L, Lu X, Zeng J, Ma X, Efferth T. Paeoniflorin protects hepatocytes from APAP-induced damage through launching autophagy via the MAPK/mTOR signaling pathway. Cell Mol Biol Lett. 2024 Sep 7;29(1):119. doi: 10.1186/s11658-024-00631-4


