【衡道丨文献】肺腺癌的更新:浸润灶尺寸、分级和气腔播散
时间:2024-09-28 06:05:30 热度:37.1℃ 作者:网络
肺腺癌分类的进展,已经导致了肺癌病理报告的显著变化。第八版的肿瘤-淋巴结转移(TNM)分期指南要求在肺肿瘤分期中,使用肿瘤浸润尺寸,代替肿瘤的总体大小。这种变化改善了预后分层,并更新了肿瘤测量方法。通过气腔传播(STAS),是肺肿瘤的另一种侵袭形式,涉及肿瘤细胞通过气腔扩散,近年来得到了广泛的研究。
2024年1月,美国纽约大学格罗斯曼医学院的Andre L Moreira博士为通讯作者,在病理学知名期刊《Histopathology》上发表题为“Updates on lung adenocarcinoma: invasive size, grading and STAS”,详尽介绍了肺腺癌病理分期、腺癌分级和STAS的最新进展,并阐述了上述当前概念在肺腺癌中的实用性和局限性。

本期甘肃省人民医院病理科陈旭老师将这篇综述要点编译如下,供相关医师参考。
浸润灶大小
2011年,肺腺癌的多学科分类引入了原位腺癌(AIS)和微浸润性腺癌(MIA)的概念。
AIS定义为无浸润性生长模式,且肿瘤直径≦3cm的腺癌。相比之下,MIA具有相同大小,且具有≦5mm浸润灶。淋巴管、血管侵犯(LVI)、胸膜侵犯、肿瘤坏死和STAS,可以排除AIS和MIA,这时病变定义为浸润性腺癌。肿瘤具有> 5 mm浸润灶,可归类为浸润性腺癌,无论肿瘤总体大小。>3cm的贴壁为主的肿瘤称为贴壁状为主型腺癌(LPA)。当AIS和MIA表现为单发病灶时,它们都与复发无关,这些病变和浸润性腺癌之间的预后差异,需要准确测量浸润灶的大小。
2017年,在TNM第八版分级系统,根据IASLC肺癌分期项目的预后信息,改变了肺腺癌的分期标准。除AIS和MIA外,第八版的分期使用浸润灶的大小,而不是肿瘤的总大小来进行分期。使用浸润灶大小,可以准确预测患者预后。
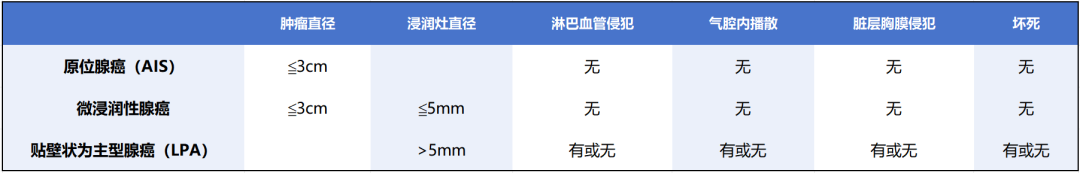
表1. AIS、MIA和LPA特点
浸润灶的特点与测量
肿瘤大小的病理测量应在大体检查和显微镜下进行细化。专家建议,应在新鲜标本中测量肿瘤大小,避免因固定所带来的测量误差。浸润灶直径应在显微镜下测量。显微镜下,对于单一浸润病灶的小肿瘤,总体大小和浸润灶大小可以用尺子测量。当浸润灶多发时,需在显微镜下算出这些浸润病灶的平均直径。病灶内瘢痕需与浸润灶相鉴别,特别是在区分AIS和浸润性腺癌时。
显微镜下,明显的中-高级别核,以及淋巴血管或胸膜受累,是明显的肿瘤侵犯迹象,但伴有人工扭曲或医源性损伤的区域,可能会误诊为腺癌。上述因素导致肺泡破裂后,产生纤维化,使肺泡壁增厚,压缩肺泡腔,形态类似于腺癌。在腺癌中,相关结缔组织间质和肺泡结构的消失,术前穿刺活检可见反应性的纤维增生。
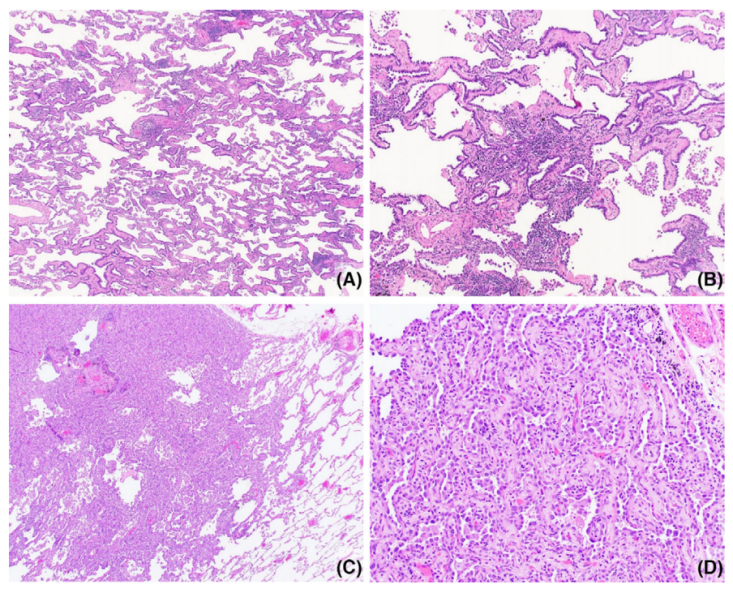
图1.原位腺癌。(A)原位腺癌显示贴壁状生长模式。(B)肺泡腔可见塌陷区域,其特征是肺泡壁增厚,类似于腺癌侵犯。然而,值得注意的是,没有促纤维结缔组织增生性间质和核异型性,诊断为肺泡塌陷,而不是浸润性腺癌。(C和D)原位腺癌伴周围肺泡塌陷,肿瘤周围肺泡壁完整,肺泡腔内可见巨噬细胞。
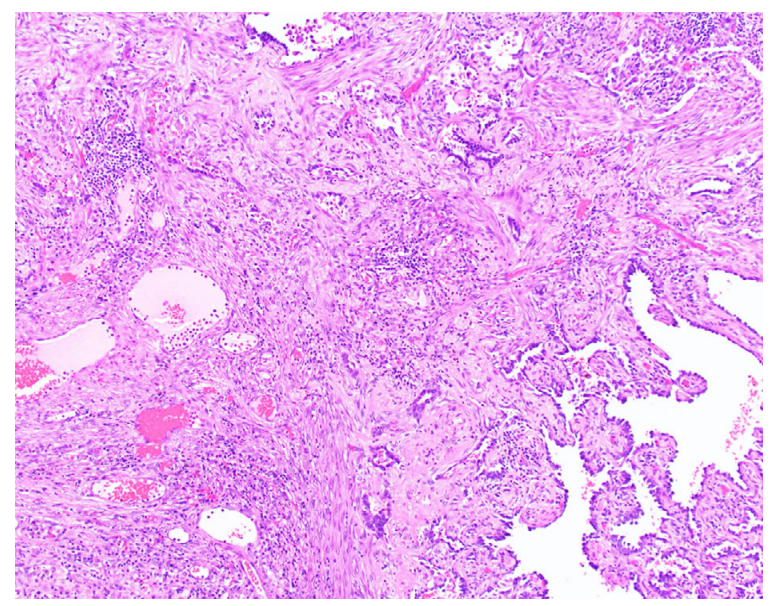
图2. 原位腺癌穿刺活检标本。病变周围可见纤维组织增生,瘢痕样组织间可见异型腺体。
弹性蛋白染色可以显示弹性框架,有助于肺泡塌陷和腺癌的鉴别,在腺癌中,弹性蛋白消失;此外在一些腺癌病例中,在伴有肺泡塌陷和贴壁生长的模式区域内,可见无结缔组织增生或间隔增厚的规则角状腺体,这些特征不能判断是否浸润。同样,高的核级别并不是浸润的明确标志,然而,核级别的转变,提示浸润可能。肺泡壁内广泛的高级别核的上皮细胞增生,具有较大的浸润概率。
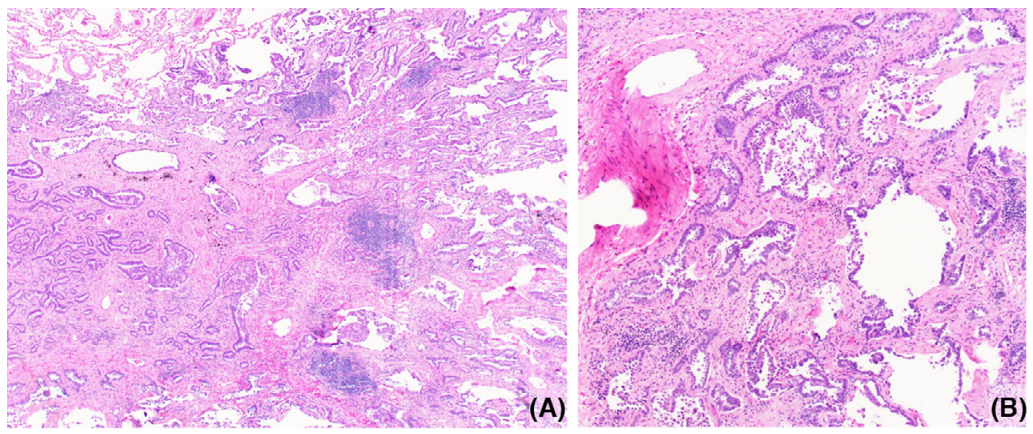
图3. 广泛的上皮细胞增生。(A)小灶浸润性腺癌,以腺泡型为主。非贴壁生长的模式,排除了AIS和MIA的诊断。(B)不规则的腺体内存在广泛的上皮细胞增生,部分上皮细胞核伴高级别改变。
影像病理联系
影像学可以测量肺部肿瘤大小,CT上的磨玻璃影,提示LPA的可能性大。实性毛糙肿物,提示浸润性腺癌的可能性大。
气腔内播散(STAS)
2015年,在WHO肺肿瘤分类中,STAS作为一种侵袭性生长形式,定义为微乳头簇、实心巢或单个细胞在主肿瘤边缘以外的空腔内扩散。STAS 由与肿瘤主体分离,并通过空域网络扩散的肿瘤细胞组成,重新附着到远离肿瘤主体的肺泡壁上,形成卫星肿瘤。无论细胞结构或模式如何,细胞在HE切片上,不显示贴壁生长模式,或与原发病变直接连接。与淋巴和血管侵犯类似,STAS 的存在,可以除外 MIA 。STAS与许多浸润性特征相关联,例如淋巴血管侵犯、脏层胸膜侵犯及高核级别,STAS 还与淋巴结转移和较高的肿瘤分期有关。
冰冻切片诊断STAS敏感性较低,且具有挑战性。肺泡内的巨噬细胞也具有类似,STAS的形态,需要角蛋白免疫组化染色协助判断。
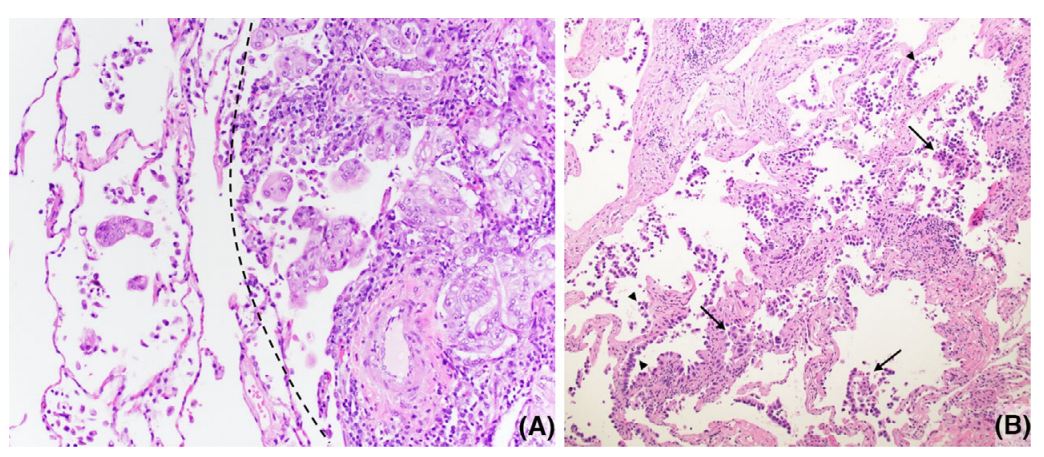
图4. STAS。(A) STAS 由肿瘤细胞簇组成,在远离肿瘤边界的空腔内,具有实心和微乳头结构(虚线)。(B)类似 STAS分布的脱离肿瘤细胞。沿着肺泡壁成型的肿瘤细胞条(箭头)和具有不规则、粗糙边缘的簇(箭头),易误判为STAS。
肿瘤分级
侵袭性肺腺癌的分类取决于结构亚型(贴壁为主型、腺泡、乳头状、微乳头状和实性),其中贴壁为主型的肿瘤为低级别,腺泡和乳头状为主的肿瘤为中级别,实体和以微乳头状为主的肿瘤为高级别。筛状腺体模式和融合腺体模式,通常统称为复杂腺体模式(CGP),目前归类为腺泡模式,其中筛状模式在 2015 年WHO分类中归于腺泡亚型的高级别模式。
IASLC 于 2020 年提出的新评分系统,包含主要模式和最高级别模式(表 2)。该系统主要基于模式分级系统,将包含 ≥ 20% 高级别模式(HGP)的任何肿瘤,升级为低分化肿瘤。此外,与CGP类似,实性和微乳头生长模式,也属于HGP范畴。
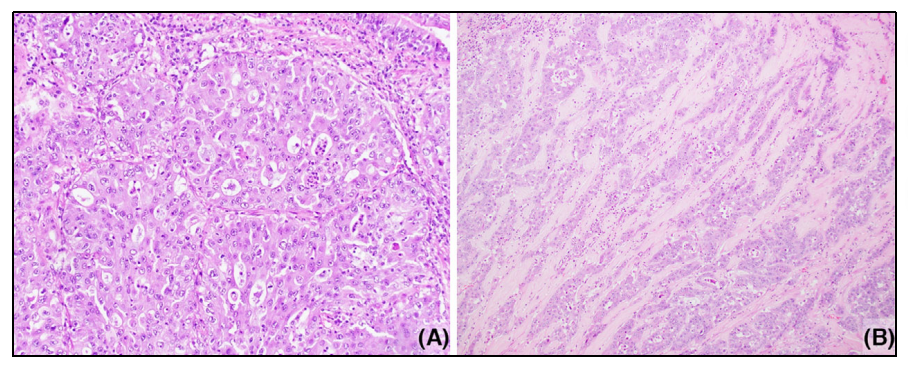
图5. 复杂的腺体模式(CGP)。具有筛状腺体的腺癌(A)特征为背靠背腺体,具有筛孔生长模式,(B)融合且不规则的腺体浸润基质。

表2. WHO浸润性肺腺癌分级方案
未来评分系统的改进方向
IASLC 分级系统的应用,仅限于浸润性非黏液性腺癌。IASLC 分级系统在活检和细胞学标本中的应用效用正在研究中,但可能由于肿瘤的异质性导致采样偏差,而使应用受到限制。因此,虽然可以在小活检样本中描述腺癌模式,但目前不建议在这些活检样本中报告组织学分级或主要模式。
小结
从测量肿瘤总体大小,到测量浸润灶大小的转变,以及新的 IASLC 分级系统的提出,改善了肺腺癌患者的预后预测,提高临床及病理医师对这种疾病的了解。这些新的分类系统,需要采用细致的方法,来测量肿瘤大小,以及区分组织学模式。新分级系统,改善了大于 3 cm的原发病灶患者的预后预测和临床管理,为研究者对肺腺癌的了解,提供了新途径。同样,STAS 对肺腺癌的预后作用,以及对肿瘤分级在治疗决策中的应用,需要进一步研究。
参考文献及书籍:
Willner J, Narula N, Moreira AL. Updates on lung adenocarcinoma: invasive size, grading and STAS. Histopathology. 2024 Jan;84(1):6-17. doi: 10.1111/his.15077. Epub 2023 Oct 23. PMID: 37872108.


