【论肿道麻】Nature Reviews Clinical Oncology:Treg细胞介导的肿瘤免疫抑制与精准免疫基因组学
时间:2024-09-06 06:00:35 热度:37.1℃ 作者:网络
越来越多的证据表明,癌细胞中由遗传异常引起的信号异常在其逃避抗肿瘤免疫中起着重要作用。免疫逃逸机制包括免疫抑制分子(如免疫检查点蛋白)表达的增强,以及免疫抑制细胞(包括调节性T细胞(Treg))在肿瘤微环境(TME)中的积累。因此,Treg细胞是癌症免疫治疗的关键靶点。2024年2月《Nature Reviews Clinical Oncology》杂志上发表了一篇名为《Regulatory T cell-mediated immunosuppression orchestrated by cancer: towards an immuno-genomic paradigm for precision medicine》的综述。这篇综述关注癌症如何利用Treg细胞逃避抗肿瘤免疫,促进肿瘤发生、进展和免疫治疗耐药的关键机制。指出了支持Treg细胞功能的癌症特征,特别是癌基因异常,将癌症免疫治疗与分子靶向药物相结合,以更有效地破坏TME中的免疫抑制网络。这种“免疫-基因组精准医学”的概念可能会提高针对各种非免疫原性癌症的治疗措施的临床疗效,包括那些对单独免疫治疗反应较差的肿瘤突变负荷(TMB) 低的癌症。
TME中Treg细胞的特征
Treg细胞的发育和抑制活性
FOXP3+ Treg细胞是CD4+ T细胞的一个免疫抑制亚群,通过控制过度和/或异常的免疫反应在维持免疫稳态中起重要作用。Treg细胞可根据其起源位置分为两个亚群,即胸腺Treg细胞(tTreg),和外周Treg细胞(pTreg细胞),也称为诱导Treg细胞(iTreg细胞)。基于FOXP3(和/或CD25)和CD45RA表达的人类FOXP3+ CD4+ T细胞的分类已经被提出。
Treg细胞通过多种机制发挥其免疫抑制活性。这些细胞大量表达免疫检查点受体CTLA4,它可以结合抗原呈递细胞(APCs)上的CD80和CD86,并阻止这些配体与效应T细胞上的共刺激受体CD28的相互作用。
Treg细胞的其他免疫抑制机制包括由于IL-2受体亚基-α(也称为CD25)的表达,这种受体对这种细胞因子具有很高的亲和力,从而对IL-2进行隔离。在IL-2消耗方面,表达CD25的Treg细胞胜过缺乏该亚基的效应性T细胞,通过IL-2的枯竭以及Treg细胞抑制共刺激信号转导诱导效应性T细胞无能和凋亡。Treg细胞也高度表达细胞表面外核苷酸酶CD39和CD73,参与TME的免疫抑制。
此外,Treg细胞产生高水平的免疫抑制细胞因子,如IL-10、IL-35和TGFβ。TGFβ是一种多效性细胞因子,在癌症中参与免疫调节和逃避,其激活过程由TGFβ激活因子GARP促进,后者在活化的Treg细胞表面表达,在多种人类癌症类型的TME中,GARP被Treg细胞特异性上调,使其成为通过抗体依赖性细胞毒性(ADCC)特异性耗尽肿瘤浸润性Treg细胞的潜在治疗靶点。
Treg细胞的代谢独特性
在TCR激活和共刺激后,T细胞将主要能量来源从氧化磷酸化(OXPHOS)转换为糖酵解,以支持其增殖、效应功能和生存。TME中葡萄糖水平受限可以限制效应T细胞的活性,而Treg细胞能够继续增殖、激活并发挥其免疫抑制功能。主转录因子FOXP3是这种代谢优势的关键。FOXP对抗对PI3K - AKT-mTORC1信号传导,和/或抑制MYC的活性,MYC是糖酵解和合成代谢的主要正调节因子(图1a),从而增加氧化和分解代谢。TME中的Treg细胞可能被重新编程以避免依赖葡萄糖代谢来发挥其抑制功能 (图1a)。Treg细胞通常上调AMP-激活的蛋白激酶,这有利于分解代谢,并依赖于脂肪酸氧化(FAO),包括脂质信号传导。此外,Treg细胞中所有电子传递链组分的表达都受到FOXP3的正调控,这使得组分成员能够利用脂肪酸为OXPHOS提供燃料。来自各种癌症患者的肿瘤内Treg细胞也有CD36的上调,CD36是脂肪酸的清除率受体,这表明外源脂肪酸摄取的增强支持了这些细胞在敌对的TME中增殖、存活和功能所需的FAO(图1a)。
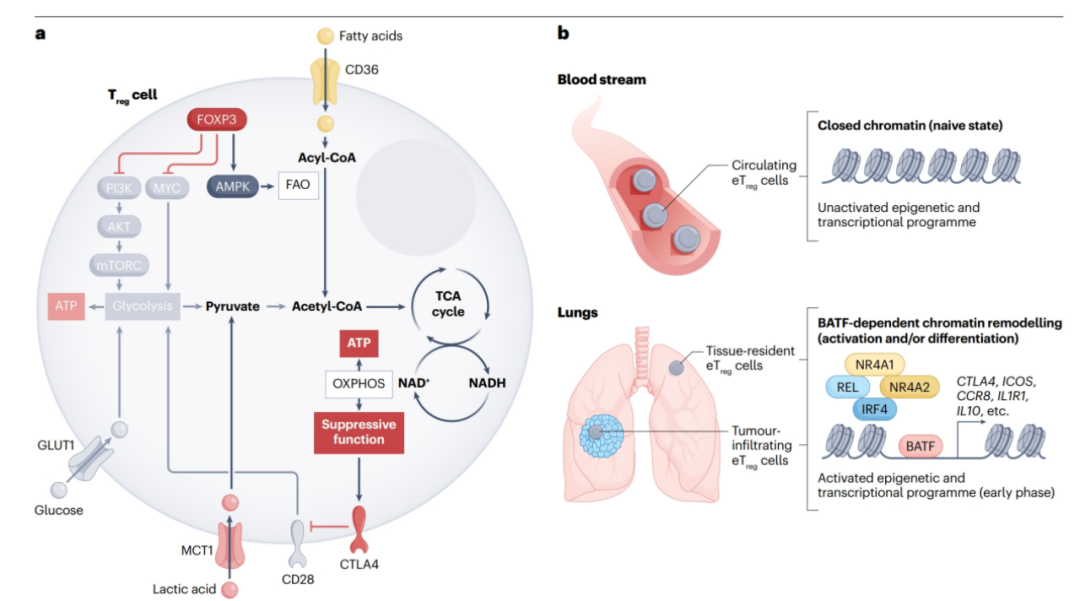
图1. 肿瘤微环境中调节性T细胞的关键特征。
TME中Treg细胞独特的分子特征
TME中的Treg细胞具有独特的表型,表达多种不同免疫检查点分子,包括CTLA4、PD-1、GITR、ICOS和TIGIT;趋化因子受体,包括CCR4和CCR8;代谢物转运蛋白,包括单羧酸转运蛋白1 (MCT1和CD36);和某些其他蛋白,包括透明质酸受体layin (LAYN)、黑色素瘤相关抗原H1 (MAGEH1)、IL-1受体1型(IL1R1)、IL1R2、IL-27亚基β (EBI3)和CD177。这种特征分子图谱为了解肿瘤浸润性Treg细胞的生物学提供了重要信息,可能有助于开发针对TME中Treg细胞的选择性靶向治疗方法。通过对肿瘤样本进行高灵敏度的分子分析,包括单细胞RNA测序,可以阐明人类肿瘤浸润性Treg细胞的异质性特征。
一项结合单细胞RNA和转座酶可及染色质(ATAC)测序的研究表明,FOXP3highCD45RA−eTreg细胞在人非小细胞肺癌(NSCLCs)中存在的染色质状态与外周血中的完全不同,这表明Treg细胞在TME中经历了动态的表观遗传和转录重编程 (图1b)。
然而,非恶性组织和肿瘤中的Treg细胞是否在分子、转录和染色质水平上具有相同的特征还有待进一步研究。且需要更多的标本和跨器官分析来阐明肿瘤特异性环境因素,包括代谢物和细胞因子,是否促进了TME中Treg细胞的进一步分化和激活。
TME中Treg细胞对抗肿瘤免疫的影响
肿瘤内Treg细胞的预后价值
肿瘤内Treg细胞的高含量与各种癌症(包括宫颈癌、肾癌和卵巢癌)的低生存率相关。研究还揭示了Treg细胞对预后的影响依赖于它们的位置,数据表明肿瘤内或循环Treg细胞的高含量,而不是肿瘤周围的Treg细胞,与较短的DFS和OS相关。在某些癌症类型中,FOXP3+ T细胞的异质性和Treg细胞的模糊定义导致了关于Treg细胞与预后之间关系的矛盾发现。方法学上的差异,以及根据肿瘤部位、分期、分子亚型和免疫细胞浸润模式的可变性,可以帮助解释Treg细胞的预后价值的差异。
此外,多项研究强调了CD8+ T细胞和Treg细胞之间距离进行空间分析对预后的重要性。进一步研究肿瘤标本的空间转录组学分析,应该可以提供机制上的见解,有助于阐明发生在癌症患者身上的TME中Treg细胞和效应T细胞之间差异性的相互作用。
PD-1阻断对Treg细胞的影响
TME中eTreg细胞表达PD-1是抗PD -(L)1抗体耐药的重要机制。在对PD-L1-PD-1阻断的反应中PD -1higheTreg细胞的免疫抑制活性增强,损害抗肿瘤免疫,甚至诱导疾病超快进展。此外,TME中PD-1+ CD8+ T细胞相对于PD-1+ eTreg细胞的数量比可以预测各种癌症(包括NSCLC、胃癌和黑色素瘤)患者抗PD -(L)1抗体的疗效。根据抗PD -(L)1抗体的敏感性和耐药性对肿瘤的分子和细胞特征进行分层,可能有助于阐明在TME中对缺乏PD-1的Treg细胞不利的因素。
Treg细胞与抗CTLA4抗体疗效的相关性
抗CTLA4抗体被认为可以促进CD28介导的共刺激,从而通过抑制CTLA4介导的Treg细胞中CD80和CD86的隔离和耗尽来增强效应T细胞的抗肿瘤活性。此外,由抗CTLA4抗体触发的Fc介导的ADCC和/或抗体依赖性细胞吞噬(ADCP)可以选择性地消耗Treg细胞,从而减轻Treg细胞介导的对细胞毒性T细胞的抑制。这些细胞群在多大程度上影响抗CTLA4抗体的抗肿瘤作用仍有争议。
TME中Treg细胞聚集和活化的机制
炎症相关性浸润
Treg细胞主要通过趋化因子网络被募集到炎症组织,以防止参与炎症反应的各种类型的效应免疫细胞的过度激活。在癌症背景下,Treg细胞浸润炎性TME并与CD8+ T细胞、DCs和其他炎性细胞共定位。在发炎的TME中,活化的CD8+ T细胞产生CCL22,这是一种已知的通过与 CCR4 结合起作用的Treg细胞趋化因子 (图3a)。生物信息学分析结果表明,TME中高度富集的IL1R1+ Treg细胞在TCR刺激后克隆扩增,并具有有效的免疫抑制活性。值得注意的是,IL1R1+ Treg细胞高度表达CTLA4,并在其他肿瘤类型中大量表达。
癌细胞的趋化因子定向募集功能
数据表明癌细胞可以通过各种机制将Treg细胞募集到非炎症的TME。某些癌细胞通过致癌改变下游激活的信号通路产生Treg细胞募集趋化因子(图3b)。表达BRAFV600E的小鼠黑色素瘤细胞分泌大量CCL2、CCL17和CCL22,它们是CCR4的配体,CCR4是一种趋化因子受体,在TME中Treg细胞上高度表达。在具有非炎症TME的EGFR突变的肺腺癌中,致癌EGFR下游JUN的激活上调了CCL22的产生,CCL22直接将CCR4+ Treg细胞募集到TME。此外,许多肿瘤的缺氧状态可促进CCL28的表达,从而在卵巢癌小鼠模型中驱动CCR10+ Treg细胞的募集。
有利的代谢适应性
在胃癌患者中,RHOA Y42突变上调FASN(编码脂肪酸合成酶)的表达,使TME中产生比没有这种突变的胃癌更多的游离脂肪酸,导致Treg细胞数量增加,而效应T细胞数量减少,从而对抗PD -1抗体产生内在抵抗。肿瘤内Treg细胞中SCAP-SREBP信号的增加也可以上调FASN,并同时促进PD-1的表达(图2)。
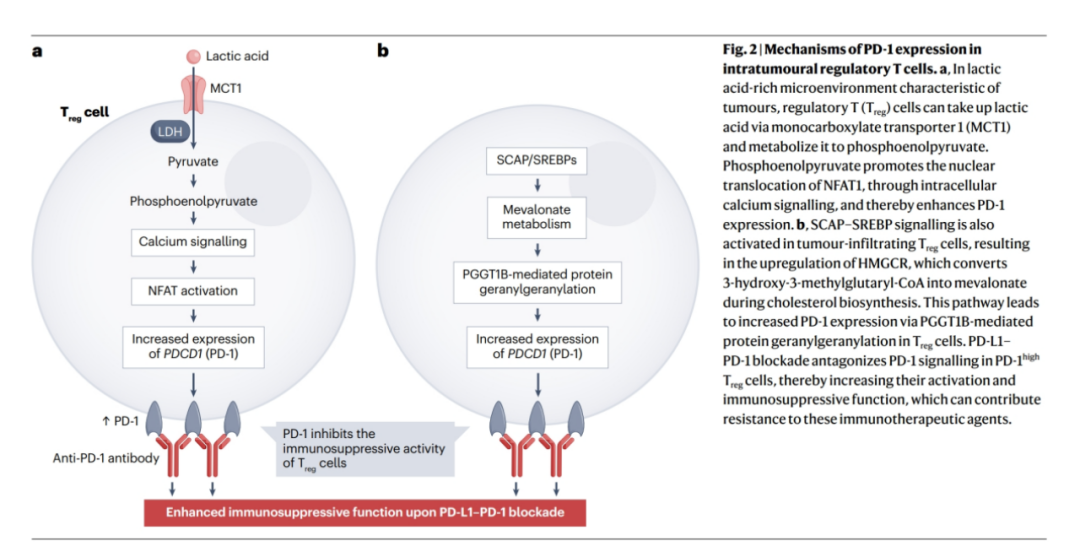
图2.肿瘤中调节性T细胞内PD -1表达的机制。
即使在氧气存在的情况下,癌细胞也通常依靠厌氧糖酵解来满足其生物合成和能量需求,这种适应被称为“Warburg代谢”。TME中低葡萄糖和高乳酸水平的微环境会抑制效应T细胞功能,阻碍免疫监视,促进TME中Treg细胞的稳定性和免疫抑制功能。
FOXP3通过下调MYC重编程Treg细胞代谢,从而抑制糖酵解,促进OXPHOS和增加NADH氧化为NAD+。相反,MYC在癌细胞中经常过度表达,导致糖酵解增强和TME中乳酸富集,而优先激活Treg细胞而不是其他多种T细胞亚群(图3c)。Treg细胞通过MCT1吸收乳酸,随后产生磷酸烯醇丙酮酸,诱导Ca2+信号,促进NFAT1的核易位,从而转录上调PD-1的表达(图2),而在MYC过表达的肿瘤中,效应T细胞上的PD-1表达减弱。因此,抗PD-1抗体主要在Treg细胞中抑制PD-1信号,而在MYC过表达的癌症或肝内肿瘤(也高度糖酵解和富含乳酸)的小鼠模型中,Treg细胞的活化与对PD-1阻断的抵抗相关。
TME中丰富的其他代谢物,如腺苷、犬尿氨酸和前列腺素E2,也可以增强Treg细胞的免疫抑制活性。
肿瘤抗原的刺激
肿瘤抗原特异性CD8+ T细胞是抗肿瘤免疫的关键介质。局限于MHC II分子的新抗原刺激的CD4+ T细胞在强大的抗肿瘤免疫应答中也是必不可少的。与MHC I-限制性抗原相比,MHC II-肽复合物可以被常规效应T细胞(Tconv)和抑制性Treg细胞识别。这些考虑提出了一个有趣的问题,即TME中的MHC II分子是否通过Tconv细胞激活诱导抗肿瘤免疫反应和/或通过刺激Treg细胞促进免疫耐受。
鉴于TME中Treg细胞识别的抗原类型尚未很好地确定,几个问题仍未解决;例如,为什么识别新抗原的Treg细胞在TME中特异性增殖,以及这些肿瘤浸润的Treg细胞最初识别哪些抗原。在某些癌症患者中,对肿瘤标本的计算分析显示,自身抗原大量由MHC II分子呈现在癌细胞上 (图3d)。为了揭示TME中Treg细胞识别的抗原库,需要对自身抗原和新抗原池进行全面分析。
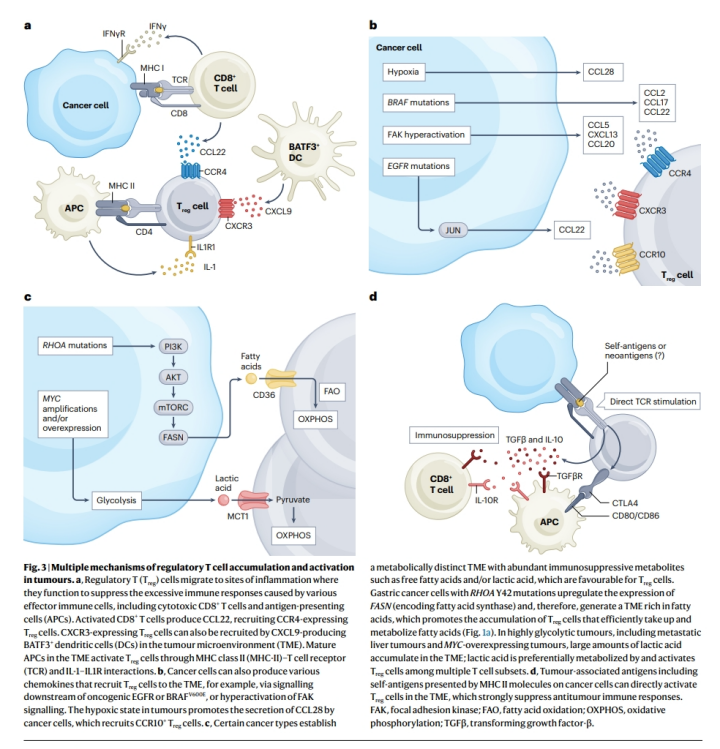
图3. 肿瘤中调节性T细胞聚集和活化的多种机制。
肿瘤源性细胞外囊泡的重编程效应
肿瘤来源的细胞外囊泡(TEVs)已被证明可以通过调节Treg细胞的功能来抑制抗肿瘤免疫反应。含有TGFβ1的TEVs可增强人CD4+ CD25+ Treg细胞的抑制功能。与非恶性细胞的上清液相比,与从HNSCC或卵巢癌细胞的上清液中纯化的TEVs共培养也显示能增加来自外周血单个核细胞的Treg细胞在体外的生成和扩增。
Treg细胞衍生的细胞外囊泡也因其潜在的免疫抑制作用而成为研究的焦点。研究表明Treg细胞衍生的细胞外囊泡含有多种microRNA,特别是具有促凋亡或抗增殖作用,还含有多种免疫抑制分子,包括CD73。因此,Treg细胞衍生的细胞外囊泡可能是癌症免疫治疗的潜在靶点。
Treg细胞调控的治疗考虑
靶向Treg细胞表达的分子
针对Treg细胞介导的免疫抑制的几种策略已经在临床或临床前进行了测试。例如,CCR8抑制剂正处于临床开发阶段,有望选择性消除肿瘤浸润性Treg细胞,但CCR8也在皮肤和脂肪中的Treg细胞表达。此外,其他被认为是肿瘤浸润性Treg细胞特异性的分子也通常由其他免疫细胞的一个亚群表达。例如,某些免疫检查点分子,如GITR和TIGIT,在Treg细胞上富集,在肿瘤抗原特异性CD8+ T细胞上也高度表达。因此,靶向这些分子的药物可能潜在地影响有害的Treg细胞和有益的肿瘤抗原特异性CD8+ T细胞。
为了提高CTLA4阻断的临床疗效,已经开发了几种新一代抗CTLA4抗体,其中的一些被设计成具有更高亲和力以激活FcγRs。这些抗体可以通过诱导ADCC和/或ADCP有效地消耗肿瘤浸润的Treg细胞,增强抗肿瘤免疫反应,同时降低剂量限制性毒性。
Treg细胞耗竭作为分子靶向药物的脱靶效应
Imatinib是一种酪氨酸激酶抑制剂(TKI),靶向致癌的BCR-ABL1融合激酶,因此用于治疗慢性髓性白血病;然而,这种药物也抑制各种其他激酶,包括淋巴细胞特异性蛋白酪氨酸激酶LCK,这是T细胞中TCR -近端信号传导的关键。Treg细胞的生存高度依赖于强大的TCR信号,因为FOXP3下调了这些细胞中LCK以及其他TCR信号分子(如ZAP70)的表达。因此,Imatinib的治疗剂量主要影响Treg细胞,而不是表达更高水平LCK的CD8+ T细胞,导致eTreg细胞的优先功能损伤和耗损,进而导致CD8+ T细胞扩张。
迈向免疫基因组精准医学
癌细胞逃避抗肿瘤免疫的过程已经根据癌症免疫编辑假说进行了经典描述,其中包括三个阶段:消除、平衡和逃避。然而,这一假说似乎并不适用于某些免疫荒漠型的癌症类型,这些癌症被发现具备免疫逃逸的机制,包括招募免疫抑制细胞,尽管缺乏之前效应免疫细胞(例如CD8+ T细胞)攻击的明显证据,这表明这些癌症在很大程度上避开了免疫编辑的初始“清除”或“平衡”阶段。许多来自使用患者肿瘤样本的研究显示,个体致癌改变可以驱动癌症的发生、进化和进展(基因组多步骤致癌),同时诱导致癌改变特异性免疫抑制机制。
为了通过各种癌症治疗策略(包括基因组分子靶向治疗和免疫治疗)改进精准医学,我们提出了“免疫-基因组癌症进化”的概念,其中每种癌症的基因组进化可以独特地塑造免疫景观,以及可称为“免疫-基因组精准医学”的相关治疗模式。我们提出了针对与癌症特定分子特征相关的免疫抑制机制的新治疗策略,特别是癌基因改变,重点关注那些涉及Treg细胞的治疗策略。一种潜在的治疗方法是靶向肿瘤细胞促进肿瘤内Treg细胞积累的免疫抑制网络,抑制这些信号通路的分子靶向药物可能成为免疫调节剂。在未来,多基因面板检测的应用可能会从目标致癌基因的识别扩展到能调节TME免疫环境的分子靶向药物的选择。
已提出的免疫-基因组精准医学模式的另一个方面涉及将基因组信息应用于为进行癌症联合免疫治疗的治疗选择和生物标志物。当临床上无法获得由驱动基因改变激活的信号通路抑制剂时,下游产生的免疫抑制TME的详细信息可能对选择最佳的癌症联合免疫疗法有价值。
其他基于免疫-基因组精准医学模式的靶向Treg细胞的潜在策略包括减轻代谢性免疫抑制TME影响的方法,如高乳酸水平。通过抑制外核苷酶CD39和CD73来靶向Treg细胞的腺苷产生,是增强抗肿瘤免疫反应的另一种有希望的策略。这一策略也可能符合我们的免疫基因组精准医学概念。
结论
癌细胞中由遗传异常引起的异常信号通过增强细胞生长和/或存活来促进肿瘤的发展。此外,这些改变促进免疫抑制细胞(如Treg细胞)向TME募集,并为这些细胞提供代谢支持,包括乳酸和/或脂肪酸。因此,通过抗癌细胞的直接细胞毒性诱导肿瘤抗原的释放,以及干扰免疫抑制成分(包括Treg细胞)的积累和激活,靶向异常的致癌信号可以有效地克服对ICI治疗的耐药性。此外,先进的科学技术,包括单细胞RNA测序和单细胞ATAC测序,已经揭示了Treg细胞被TME中一个特征性的染色质重塑过程激活,转录因子如BATF是这一过程的关键调节因子,潜在的机制不仅涉及抗原刺激,还涉及FOXP3驱动的细胞重编程的代谢特性。这些发现提示了靶向Treg细胞的其他策略,这些策略基于癌基因下游信号传导产生的TME的特征。总之,将癌症免疫治疗与分子靶向药物结合起来,根据个体患者的癌症特征,特别是癌基因改变和/或与这种改变相关的TME的某些特征,破坏免疫抑制癌症网络,可以提高免疫治疗对各种癌症类型的疗效。因此,实现免疫基因组精准医学可能是癌症免疫治疗成功的关键一步。
述评:
这篇《Nature Reviews Clinical Oncology》杂志上的综述文章,深入剖析了调节性T细胞(Treg细胞)在肿瘤免疫逃逸中的关键角色,并提出了免疫基因组精准医学的新策略。文章的核心观点是,肿瘤细胞的遗传异常不仅促进肿瘤生长,还通过增强免疫抑制分子的表达和招募Treg细胞来逃避免疫系统的攻击。作者强调了Treg细胞在肿瘤微环境中的积累与多种癌症预后不良的密切关联,并讨论了Treg细胞如何在肿瘤微环境中获得代谢优势,特别是通过FOXP3转录因子的调控。
文章提出的“免疫基因组精准医学”概念,是对传统癌症免疫治疗的重要补充。这一概念强调了根据肿瘤的遗传特征和肿瘤微环境的免疫学背景来定制个性化的治疗方案的重要性。作者通过分析Treg细胞的特性和功能,为开发新的免疫治疗策略提供了理论基础,尤其是在如何更有效地耗尽或阻断Treg细胞的免疫抑制功能方面。此外,文章还探讨了多种针对Treg细胞的治疗策略,包括抗CTLA4抗体的使用、分子靶向药物和其他能够调节肿瘤微环境中免疫抑制网络的药物。这些策略的目的是解除Treg细胞的免疫抑制,从而增强机体对肿瘤的免疫反应。
总的来说,这篇综述文章为癌症免疫治疗领域提供了新的视角和策略。它不仅增进了我们对Treg细胞在肿瘤免疫逃逸中作用的理解,也为未来的临床治疗提供了可能的新方向。
参考文献:
Shogo Kumagai, Kota Itahashi1& Hiroyoshi Nishikawa. Regulatory T cell-mediated immunosuppression orchestrated by cancer: towards an immuno-genomic paradigm for precision medicine. Nature Reviews Clinical Oncology. 21,337-353( 2024).


