陕西师范大学唐艳丽教授课题组ACS Nano: 基于共轭聚合物复合纳米粒子的钙介导细胞黏附增强实现抗转移和抗肿瘤协同治疗
时间:2024-09-05 14:00:56 热度:37.1℃ 作者:网络

我国癌症的发病率持续上升,癌症已经成为威胁人类身体健康的主要原因之一。尽管癌症治疗取得了蓬勃发展,但肿瘤转移仍然是癌症治疗中最具挑战性的问题。作为原发肿瘤的种子,循环肿瘤细胞有能力脱离主要肿瘤组织,通过血液或淋巴系统,寻找其他位置定居并生长为转移性肿瘤。据报道,癌症转移是导致癌症相关死亡的主要诱因。因此,迫切需要开发更为高效且具有抑制转移效果的癌症治疗策略。
钙黏素是参与细胞间粘附的关键分子之一,通过同源聚合的机制并依赖Ca2+介导细胞黏着。当细胞外Ca2+浓度足够高时,所有的钙结合位点都会被饱和,这时钙粘蛋白就会采用刚性的棒状二聚体构象来增强其黏附功能。因此,通过调节细胞外Ca2+浓度来增强肿瘤细胞黏附有望用于抗肿瘤转移治疗。Ca2+作为一种普遍存在的第二信使,正常情况下,由于线粒体和内质网的缓冲功能以及许多跨膜泵或通道的Ca2+运输,细胞内Ca2+稳态很难被破坏。然而,氧化应激对钙通道和亚细胞器造成不可逆的损伤,使细胞Ca2+水平不能被调节到正常状态,导致钙超载诱导的细胞死亡。因此,利用光动力疗法(PDT),结合钙超载,有望实现高效的抗肿瘤治疗。然而,目前为止,具有钙介导的抗转移和钙超载+PDT联合抗肿瘤的钙复合生物材料尚未见报道。
近期,陕西师范大学唐艳丽教授课题组设计合成了一种具备高效的抗肿瘤和抗转移功效的碳酸钙-共轭聚合物复合纳米粒子PFV/CaCO3/PDA@PEG(图1),该纳米粒子在肿瘤弱酸性环境中破裂分解,释放出的共轭聚合物和Ca2+可通过PDT和钙超载协同作用高效地杀死肿瘤细胞,并通过增大细胞外Ca2+水平增强肿瘤细胞膜上的钙黏素黏连,达到抑制肿瘤细胞脱落转移的效果。因此,这项工作为设计同时抑制肿瘤生长和转移的纳米药物用于治疗癌症提供了新策略。相关工作以“Calcium-Mediated Cell Adhesion Enhancement-Based Antimetastasis and Synergistic Antitumor Therapy by Conjugated Polymer–Calcium Composite Nanoparticles”为题发表在《ACS Nano》上。
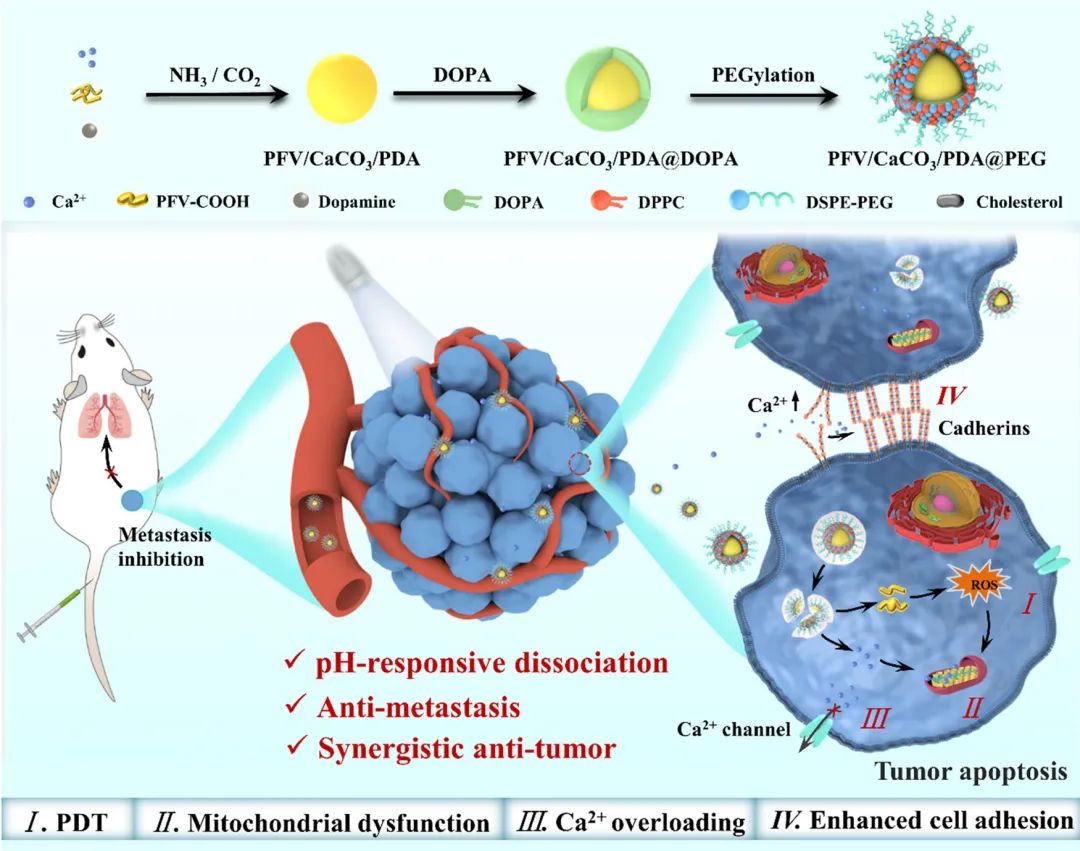
图1:PFV/CaCO3/PDA@PEG复合纳米粒子的抗肿瘤抗转移机理图
为了使共轭聚合物与Ca2+具有良好的配位能力,作者设计并合成了在侧链上含有2个氨基和4个羧酸基团的水溶性共轭聚合物PFV-COOH,其羧氨结构与乙二胺四乙酸相似,可有效配位Ca2+(图2a)。进一步地,通过气相扩散法成功制备了共轭聚合物-钙复合纳米粒子PFV/CaCO3/PDA@PEG(图2b)。
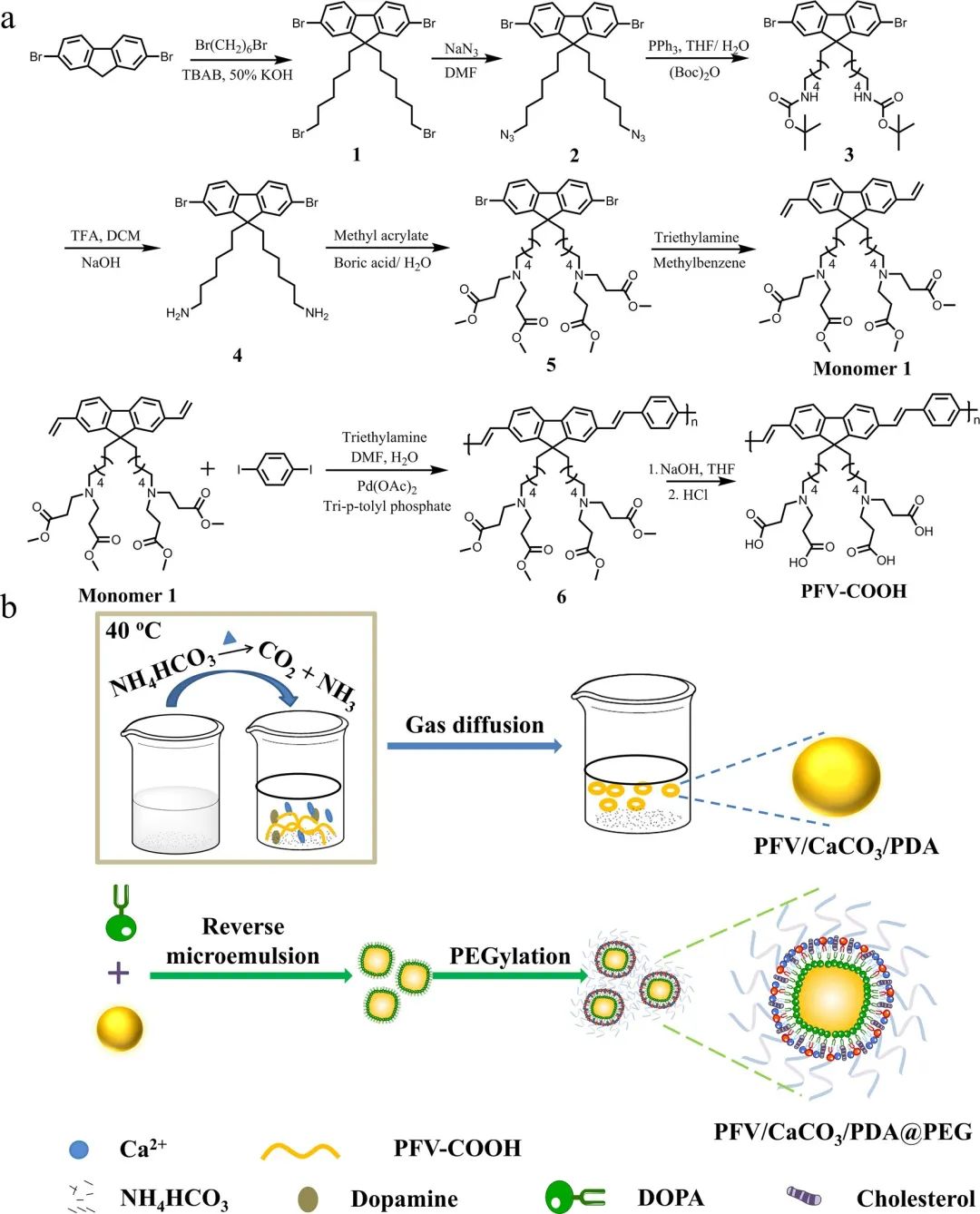
图2:PFV-COOH的合成路线及PFV/CaCO3/PDA@PEG复合纳米粒子的制备示意图
作者首先在细胞水平探究了所制备的PFV/CaCO3/PDA@PEG的抗肿瘤机理。利用活性氧指示剂DCFH-DA进行测试,结果显示,光照处理的PFV-COOH和PFV/CaCO3/PDA@PEG在细胞内更高效地产生ROS(图3a)。与此同时,CaCO3/PDA@PEG组也呈现出较弱的绿色荧光,表明Ca2+的持续积累也会放大细胞内的氧化应激水平。以上结果表明,光照条件下纳米粒子产生的ROS以及钙超载,可双重放大细胞内氧化应激水平,这对于提高肿瘤治疗效果具有关键作用。线粒体作为细胞的能量工厂,是细胞凋亡、钙稳态等多种信号通路之间的关键纽带,据报道,细胞内钙超载会导致线粒体功能障碍,从而触发细胞死亡。作者利用线粒体JC-1染料作为评价线粒体功能的探针。结果显示,在光照条件下,PFV/CaCO3/PDA@PEG孵育后的细胞显示出更强的绿色荧光,表明该纳米粒子对线粒体具有更强的损伤(图3b-c)。茜素红染色实验证实了PFV/CaCO3/PDA@PEG+光照实验组钙结节含量显著增强(图3d、e)。MTT细胞毒性实验也显示光照纳米粒子组具有显著的抗肿瘤治疗效果(图3f)。以上实验表明PFV/CaCO3/PDA@PEG具有PDT和钙化双重抗肿瘤治疗功能。
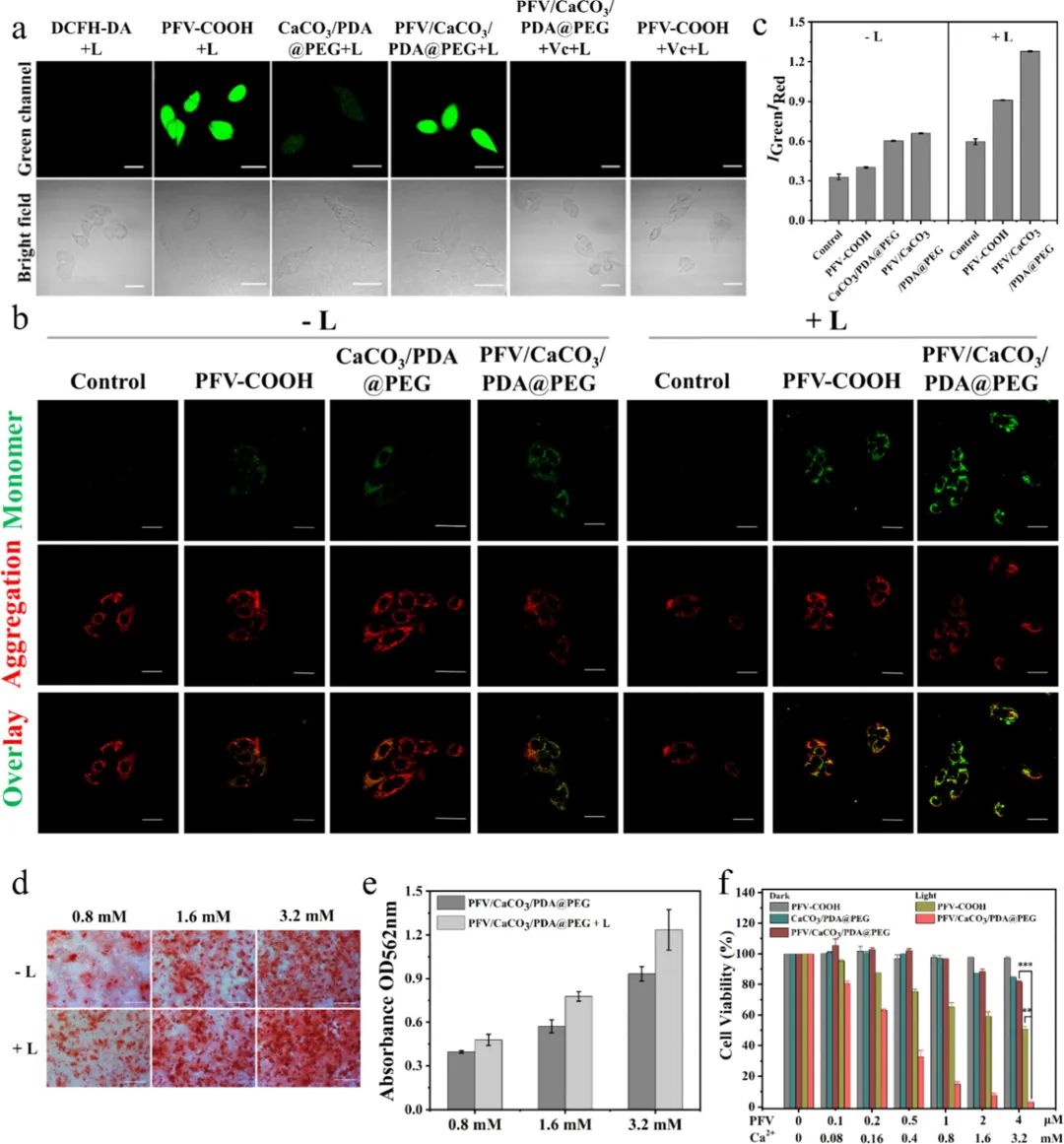
图3:PFV/CaCO3/PDA@PEG复合纳米粒子的抗肿瘤性能评估
据报道,当细胞外钙浓度小于0.05 mM时,钙粘蛋白只能维持较弱的刚性,导致细胞间黏连减弱。随着细胞外钙浓度的升高,相邻的钙黏蛋白相互作用形成钙黏蛋白顺式二聚体或反式二聚体(图4a)。PFV/CaCO3/PDA@PEG纳米颗粒在肿瘤酸性环境中发生裂解,导致细胞外Ca2+浓度维持在较高水平。因此,可以推断只有顺式二聚体或反式二聚体的存在,这将大大增强钙黏素结构域间连接的刚性,降低癌细胞转移的概率。划痕实验和Transwell迁移实验表明,PFV/CaCO3/PDA@PEG纳米粒子对于4T1和MCF-7细胞具有显著增强细胞黏附、降低细胞迁移概率的效果(图4b-g),有力地证实了上述结论。同时,该策略也为癌症转移的抑制提供了新思路。
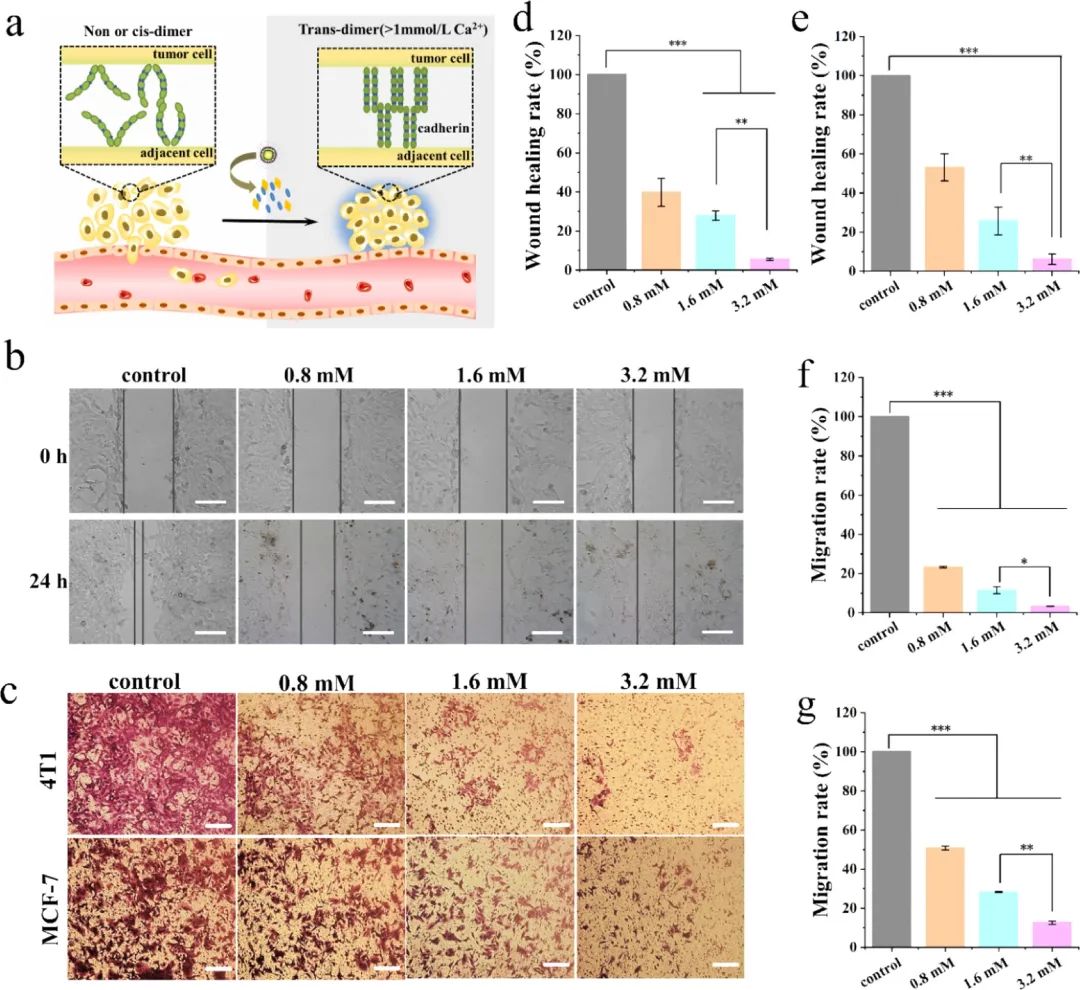
图4:PFV/CaCO3/PDA@PEG复合纳米粒子的抗转移性能评估
为了研究PFV/CaCO3/PDA@PEG在体内的抗肿瘤治疗效果,作者使用Balb/c小鼠建立了转移型4T1荷瘤小鼠模型(图5),尾静脉注射PFV/CaCO3/PDA@PEG纳米粒子后,经过光疗,第20天肿瘤抑制率达到89%,再次证实了PFV/CaCO3/PDA@PEG光照组具有协同高效的抗肿瘤功效。对21天的小鼠进行解剖并摘取各组小鼠的肺器官,并用Bouin’s溶液进行固定染色,观察小鼠肺部的转移情况(图6),实验结果表明,PFV/CaCO3/PDA@PEG治疗组小鼠的肺转移结节相较于对照组显著减少,抗转移抑制率达到88%,表明PFV/CaCO3/PDA@PEG光照组具有显著的体内抗肿瘤转移治疗效果。
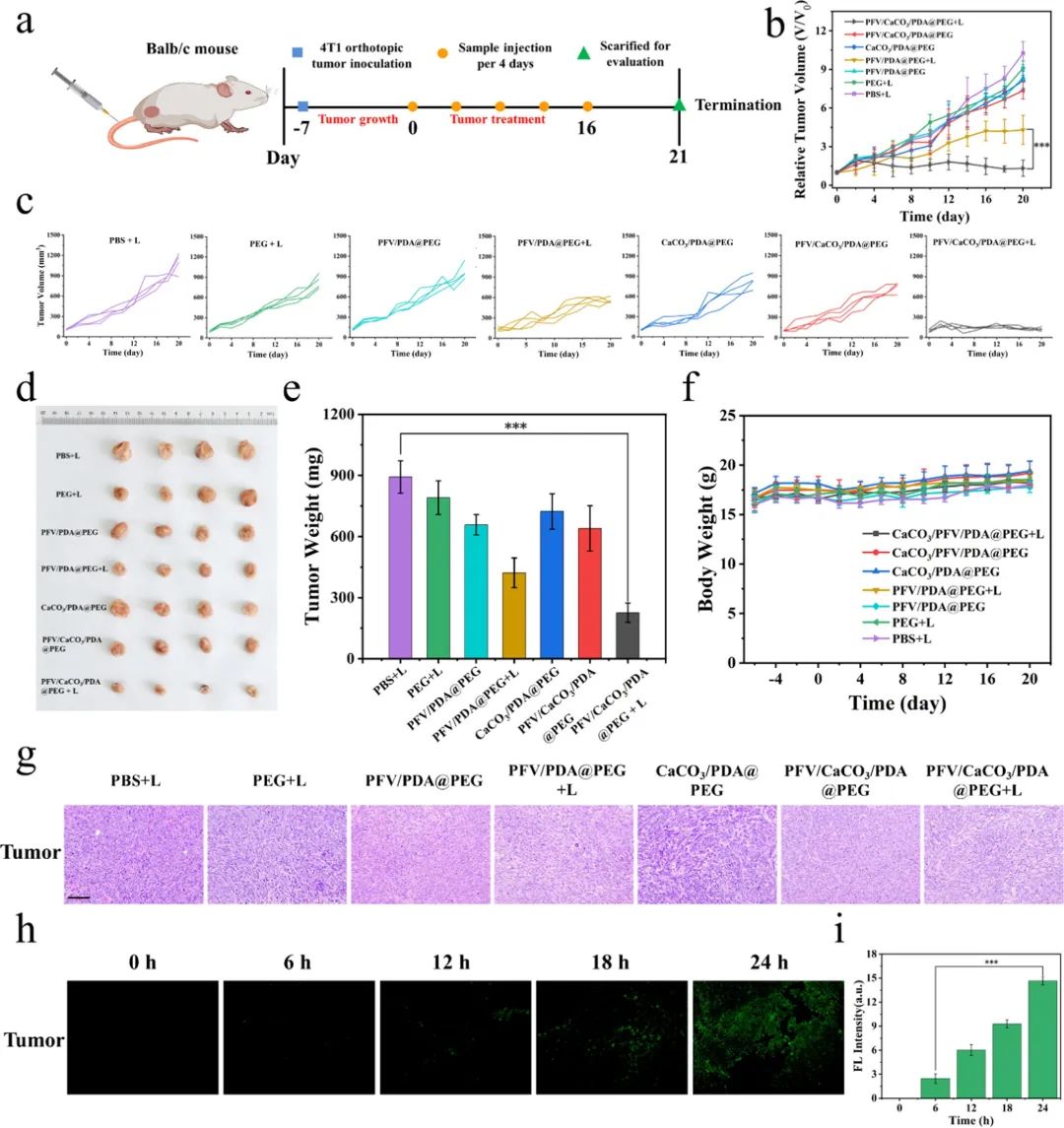
图5:PFV/CaCO3/PDA@PEG复合纳米粒子对4T1荷瘤小鼠的治疗效果
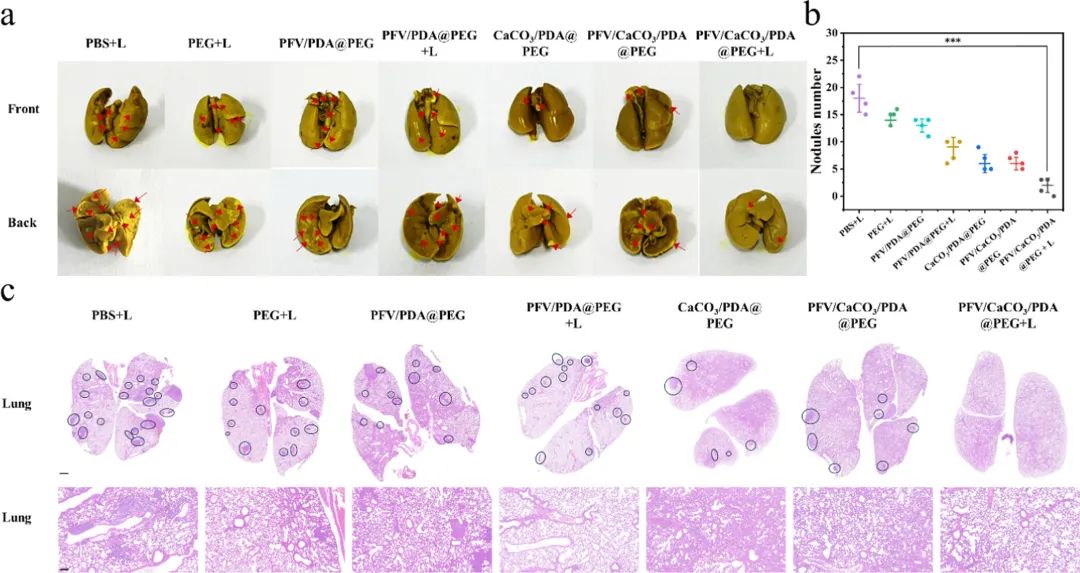
图6:PFV/CaCO3/PDA@PEG复合纳米粒子的抗转移治疗效果
综上所述,该研究工作提供了一种新的肿瘤微环境激活的多功能纳米平台,为癌症治疗和抑制肿瘤转移提供了新方法。
陕西师范大学化学化工学院唐艳丽教授为该论文的唯一通讯作者,硕士研究生贺俊妮、王谕泽和任雨欣为该论文共同第一作者。该工作得到了国家自然科学基金委、陕西省科技厅和中央高校基本科研业务费专项资金的资助,在此表示感谢。
原文链接:


