JACC-BTS 上海瑞金医院谢玉才/国家转化医学中心(上海)印彤团队合作揭示SIRT1改善lamin A/C缺失所致心功能障碍
时间:2024-09-02 18:00:15 热度:37.1℃ 作者:网络
LMNA基因编码核膜核纤层蛋白A和C (Lamin A/C)1。LMNA基因变异会导致一系列具有异质性表现的临床疾病,统称为laminopathies2。据报道,5-10%的特发性扩张型心肌病(DCM)和5%的家族性DCM与LMNA基因突变有关。LMNA基因突变导致的DCM (LMNA-DCM)患者泵衰竭和早期死亡的风险较高,患者通常预后较差,然而目前LMNA-DCM的治疗方法仍然有限3, 4。
近期的RNA测序研究表明,LMNA基因敲除小鼠心脏氧化磷酸化(OXPHOS)受损5。此外,一些LMNA基因突变可导致小鼠成肌细胞的线粒体解偶联6。progerin是一种具有毒性的截短的prelamin A蛋白,可导致过早衰老,其积累显著诱导线粒体功能障碍7。而目前LMNA基因变异在多大程度上导致心肌细胞线粒体生物能量损伤及其潜在机制尚不清楚。
Sirtuins蛋白家族是一类依赖NAD+的III类组蛋白去乙酰化酶,其中Sirtuins 1 (SIRT1)最早被发现,其在衰老、细胞凋亡、热量限制和代谢稳态等方面发挥多种作用8。Sirtuins蛋白家族与lamin A/C关系密切,在基于laminopathies的早衰小鼠模型中,激活SIRT1、SIRT6、SIRT7可显著改善小鼠的过早死亡9-11。因此,探究sirtuins蛋白是否在心脏laminopathies中发挥作用具有重要意义。
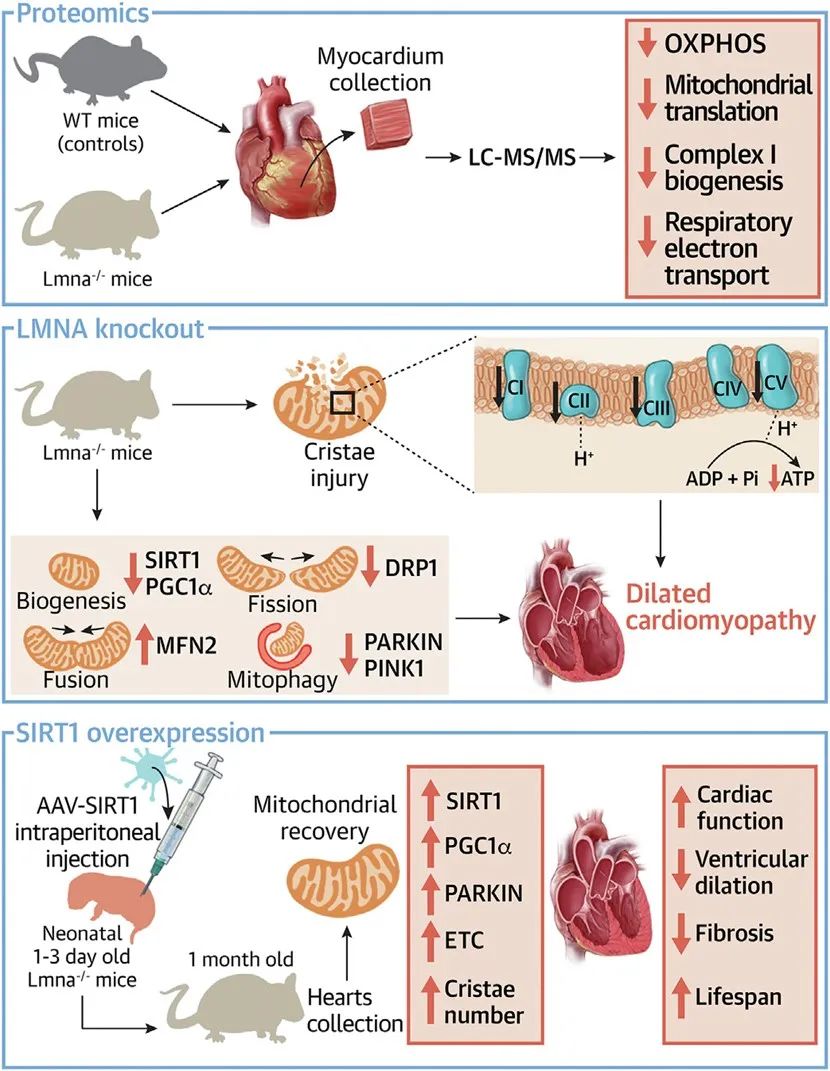
2024年8月21日,上海交通大学医学院附属瑞金医院心脏内科谢玉才教授/国家转化医学中心(上海)印彤教授团队合作在JACC: Basic to Translational Science杂志上发表题为“SIRT1 ameliorates lamin A/C deficiency-induced cardiac dysfunction by promoting mitochondrial bioenergetics”的研究论文。该研究基于蛋白组学,发现在明显的DCM表型出现之前,Lmna-/-小鼠心脏就已经表现出线粒体功能障碍和SIRT1表达下调。腺相关病毒(AAV)介导的SIRT1过表达可通过上调PARKIN,至少部分改善lamin A/C缺失所致线粒体损伤和心功能障碍。这些发现表明,SIRT1-PARKIN信号轴可能成为治疗LMNA-DCM的新靶点。

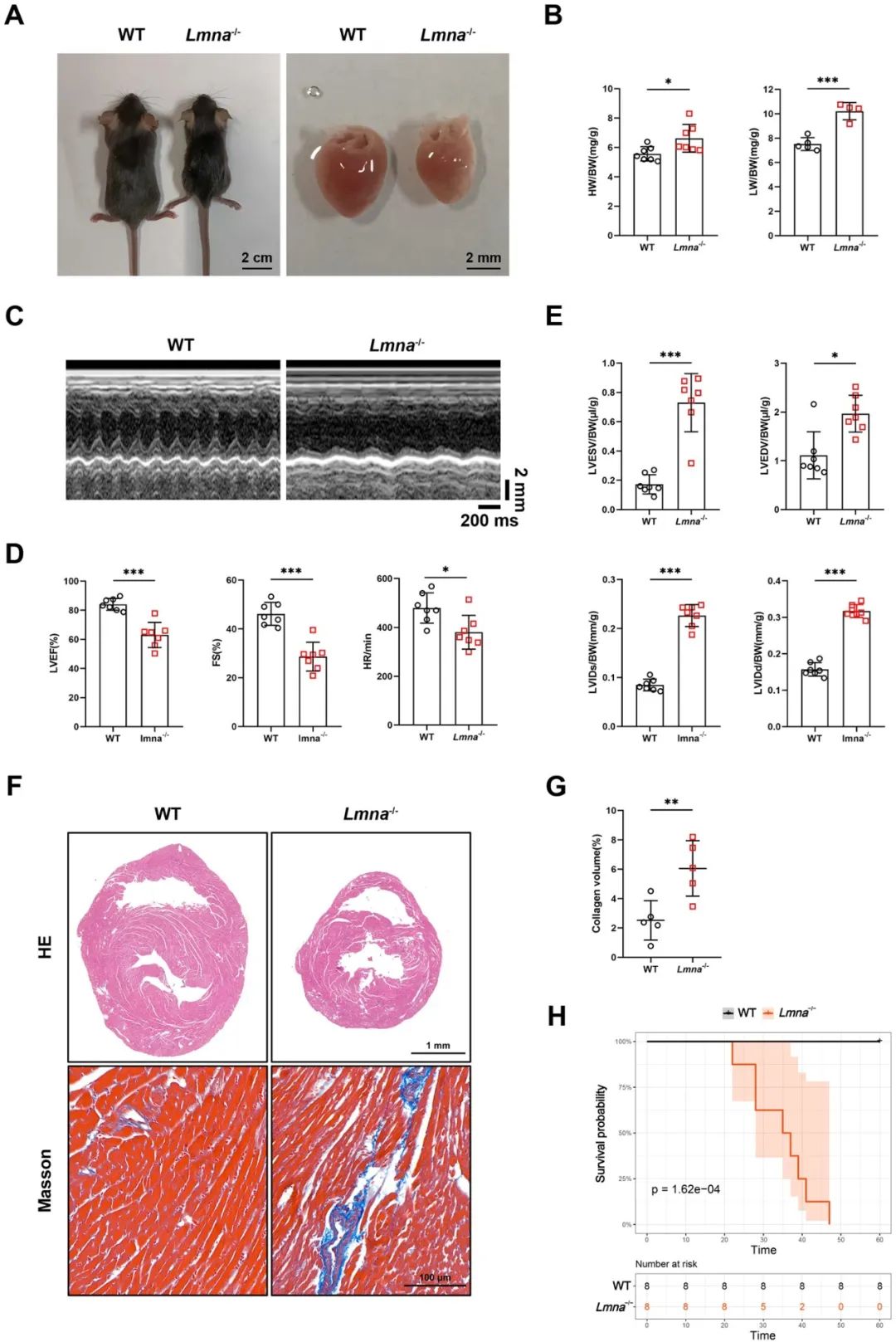
首先,研究者利用CRISPR/Cas9技术敲除LMNA基因8到11外显子,成功构建了Lmna-/-小鼠。进一步对1月龄和2周龄Lmna-/-小鼠进行表型分析,1月龄Lmna-/-小鼠体型、心脏外观、心脏重量/体重、超声心动图参数和组织学分析结果均表现异常,出现DCM表型,而2周龄Lmna-/-小鼠仅心脏重量和体重低于对照组,处于未发病期。Lmna-/-小鼠中位生存时间为36天。
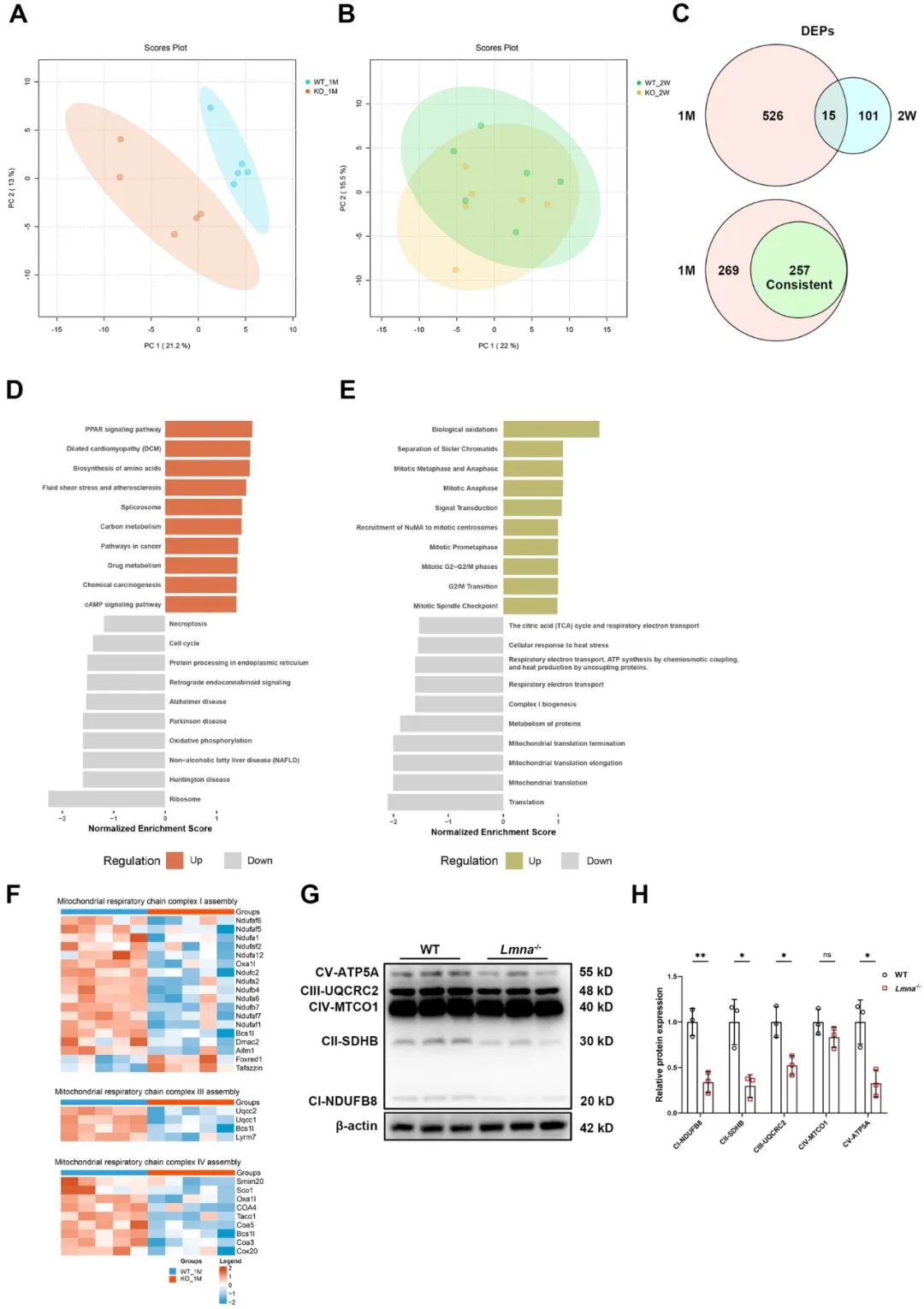
为进一步探究lamin A/C缺失所致DCM的发病机制,研究者对1月龄和2周龄Lmna-/-小鼠心肌组织进行了非靶向蛋白组学检测,筛选出显著差异表达蛋白(DEPs),其中在2周龄到1月龄呈进展性变化的DEPs有257个。KEGG和Reactome富集分析发现,OXPHOS、线粒体翻译、复合体Ⅰ生物发生、呼吸链电子传递等线粒体相关信号通路显著下调。
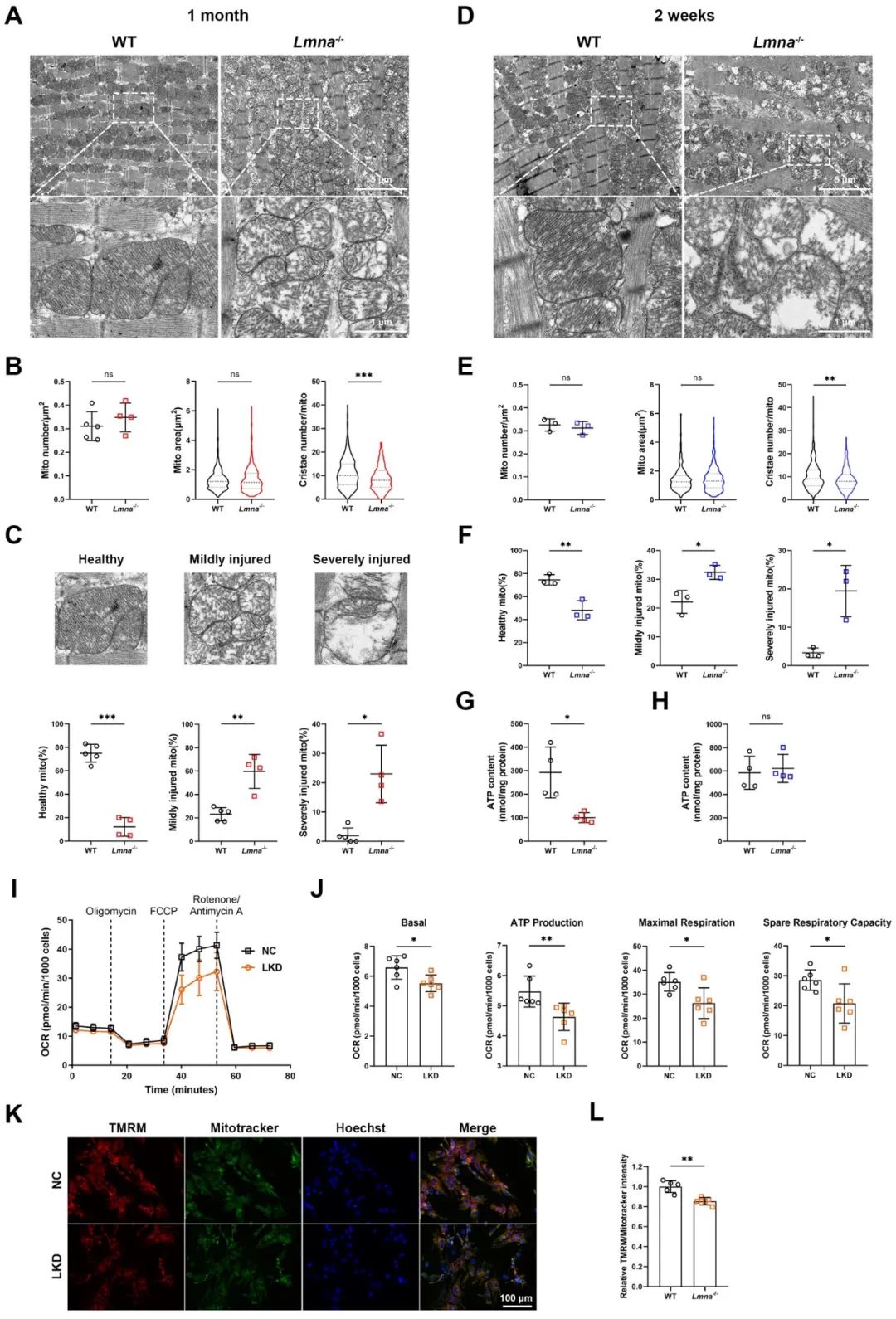
为了进一步确定lamin A/C缺失导致线粒体损伤的时期,研究者利用透射电镜观察心肌线粒体超微结构,1月龄和2周龄Lmna-/-小鼠心肌线粒体都出现了嵴稀疏且排列紊乱,密度降低,损伤线粒体比例增加,提示线粒体损伤始于LMNA-DCM早期。同样,lamin A/C缺失的新生大鼠心肌细胞(NRVMs)也出现线粒体呼吸能力下降和膜电位降低。
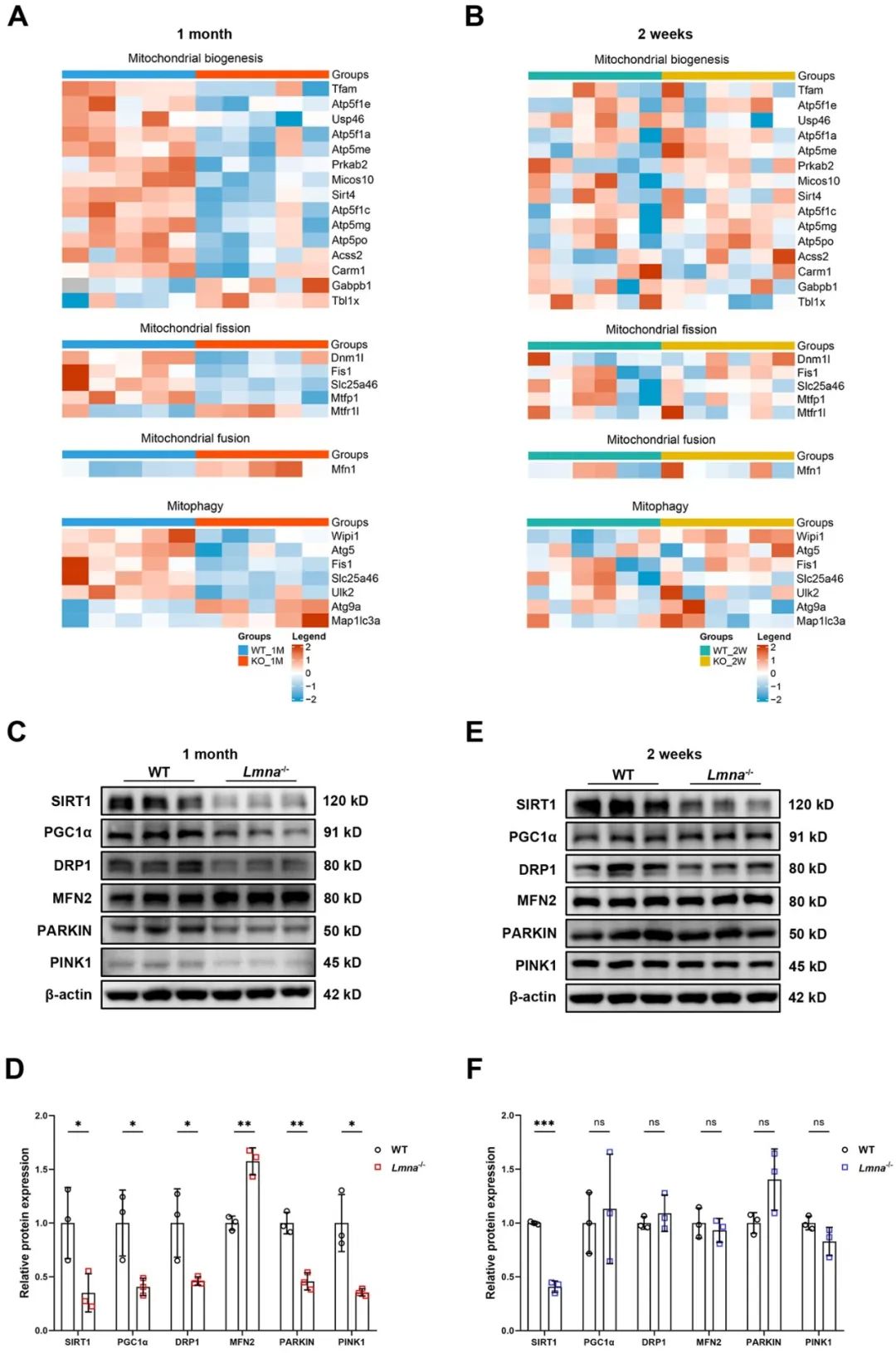
线粒体质量控制是线粒体对抗应激并保持其健康和完整的重要过程12。热图显示,在1月龄Lmna-/-小鼠心脏中,与线粒体生物发生、分裂、线粒体自噬相关的蛋白呈下调趋势,而与线粒体融合相关的蛋白呈上调趋势。WB结果也证实线粒体生物发生(SIRT1、PGC1α)、分裂(DRP1)、自噬(PARKIN、PINK1)调控因子下调,融合(MFN2)上调。而在这些调控因子中,只有SIRT1在2周龄Lmna-/-小鼠心脏中下调,可能是促进DCM发生发展的早期机制。
为进一步探究SIRT1下调在Lmna-/-小鼠心脏中发挥的作用,研究者在体内外水平分别构建了SIRT1过表达的腺相关病毒(AAV-SIRT1)和腺病毒(Ad-SIRT1),并发现SIRT1过表达可显著恢复lamin A/C缺失NRVMs的氧化呼吸能力,包括基础呼吸、ATP生成水平、最大呼吸和储备呼吸能力的提高,线粒体膜电位也部分恢复。同样,在AAV-SIRT1注射4周后,Lmna-/-小鼠心脏线粒体嵴损伤和形态异常部分恢复。
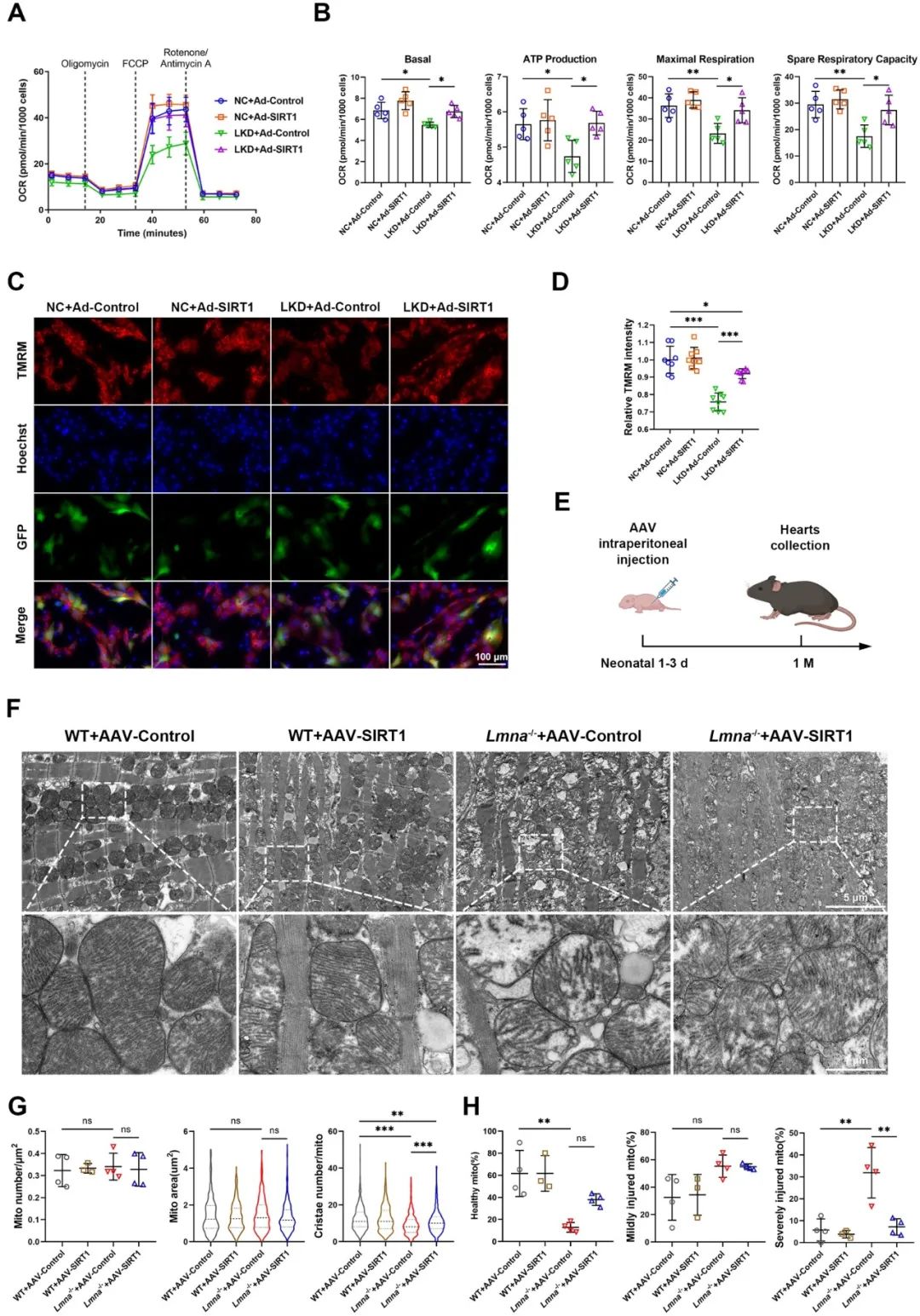
接下来,研究者探究了AAV-SIRT1给药对Lmna-/-小鼠心脏表型的治疗效果。超声心动图分析显示,AAV-SIRT1处理的Lmna-/-小鼠的左室射血分数和心率均显著改善,组织学分析表明,尽管心脏大小未改变,但AAV-SIRT1给药后Lmna-/-小鼠心室扩张有所恢复,心肌纤维化减少。注射AAV-SIRT1的Lmna-/-小鼠的中位生存时间延长至48.5天。这些结果表明,过表达SIRT1至少部分逆转Lmna-/-小鼠DCM表型。
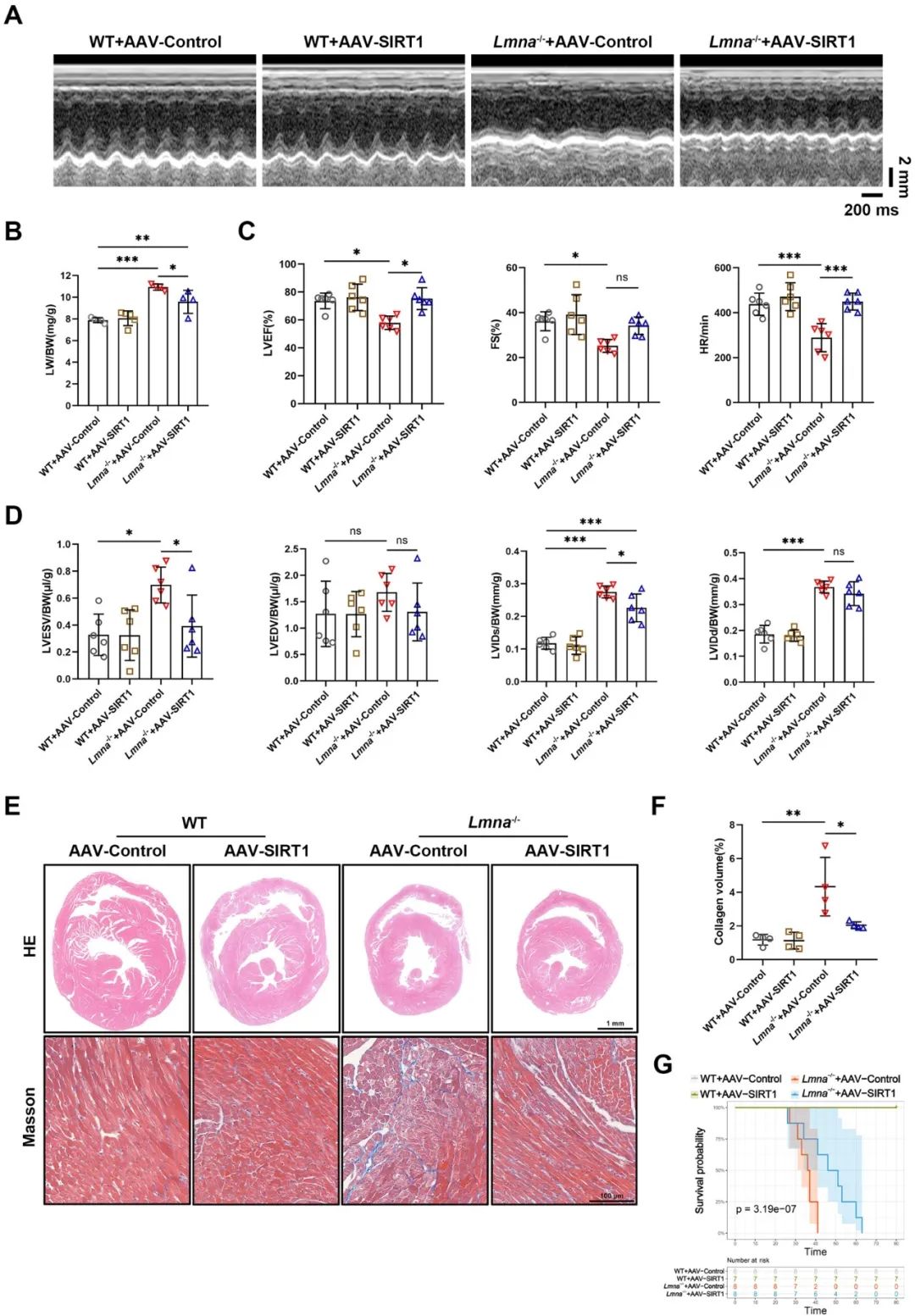
为进一步揭示Lmna-/-小鼠中SIRT1保护心脏线粒体生物能量学的潜在机制,研究者在给予AAV-SIRT1后1个月检测了小鼠心脏线粒体相关蛋白的表达。结果表明,SIRT1显著上调了PGC1α、PARKIN以及呼吸链复合体Ⅰ、Ⅱ、Ⅲ、Ⅴ的表达水平,而对DRP1、MFN2、PINK1的表达没有影响。进一步在NRVMs中敲减PARKIN,发现PARKIN敲低完全消除了lamin A/C缺乏时SIRT1对氧化呼吸能力的保护作用,表明lamin A/C通过SIRT1-PARKIN信号轴调节线粒体功能。
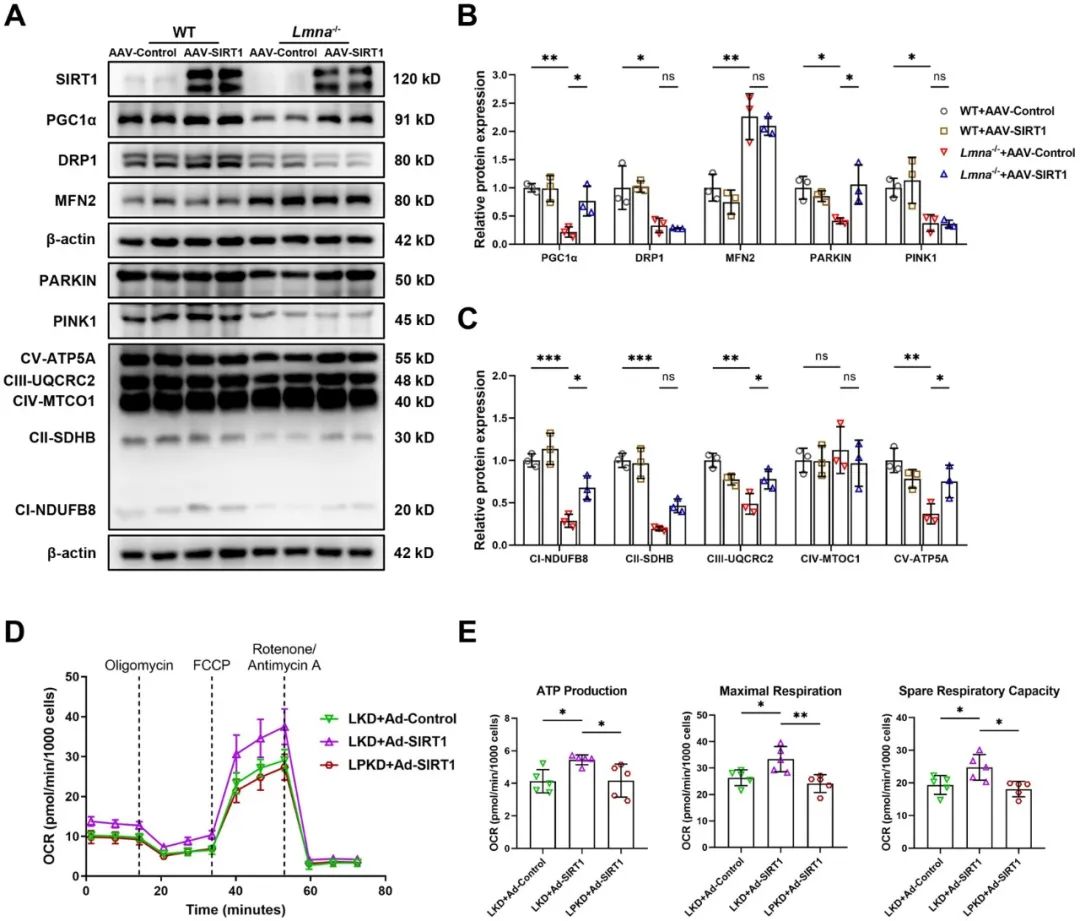
综上所述,研究者发现Lmna-/-小鼠心脏表现出线粒体结构和功能损伤,以及线粒体质量控制紊乱,包括线粒体生物发生损伤、裂变和融合失衡以及线粒体自噬缺陷。在Lmna-/-小鼠中,SIRT1过表达改善了由lamin A/C缺乏引起的心肌线粒体损伤和DCM表型。机制上,本研究阐明了LMNA通过SIRT1-PARKIN信号轴保护线粒体生物能量学,为LMNA-DCM提供了新的治疗靶点。
上海交通大学医学院附属瑞金医院心脏内科杜遵辉博士和国家转化医学中心(上海)周艳婷为论文的共同第一作者,瑞金医院心脏内科谢玉才教授和国家转化医学中心(上海)印彤教授为本文共同通讯作者。本研究获得国家自然科学基金、国家转化医学研究中心(上海)开放课题等项目资助。
参考文献:
1. Lin F, Worman HJ. Structural organization of the human gene encoding nuclear lamin A and nuclear lamin C. J Biol Chem 1993;268:16321-6.
2. Worman HJ. Nuclear lamins and laminopathies. J Pathol 2012;226:316-25.
3. Weintraub RG, Semsarian C, Macdonald P. Dilated cardiomyopathy. Lancet 2017;390:400-414.
4. Glikson M, Nielsen JC, Kronborg MB et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J 2021;42:3427-3520.
5. Shao Z, Koh W, Ni Y et al. RNA Sequence Analyses throughout the Course of Mouse Cardiac Laminopathy Identify Differentially Expressed Genes for Cell Cycle Control and Mitochondrial Function. Sci Rep 2020;10:6632.
6. Ignatieva EV, Ivanova OA, Komarova MY et al. LMNA Mutations G232E and R482L Cause Dysregulation of Skeletal Muscle Differentiation, Bioenergetics, and Metabolic Gene Expression Profile. Genes (Basel) 2020;11.
7. Xu X, Wang D, Zheng C et al. Progerin accumulation in nucleus pulposus cells impairs mitochondrial function and induces intervertebral disc degeneration and therapeutic effects of sulforaphane. Theranostics 2019;9:2252-2267.
8. Karbasforooshan H, Karimi G. The role of SIRT1 in diabetic cardiomyopathy. Biomed Pharmacother 2017;90:386-392.
9. Liu B, Ghosh S, Yang X et al. Resveratrol rescues SIRT1-dependent adult stem cell decline and alleviates progeroid features in laminopathy-based progeria. Cell Metab 2012;16:738-50.
10. Ghosh S, Liu B, Wang Y, Hao Q, Zhou Z. Lamin A Is an Endogenous SIRT6 Activator and Promotes SIRT6-Mediated DNA Repair. Cell Rep 2015;13:1396-1406.
11. Sun S, Qin W, Tang X et al. Vascular endothelium-targeted Sirt7 gene therapy rejuvenates blood vessels and extends life span in a Hutchinson-Gilford progeria model. Sci Adv 2020;6:eaay5556.
12. Wu L, Wang L, Du Y, Zhang Y, Ren J. Mitochondrial quality control mechanisms as therapeutic targets in doxorubicin-induced cardiotoxicity. Trends Pharmacol Sci 2023;44:34-49.
原文链接:
https://www.jacc.org/doi/10.1016/j.jacbts.2024.05.011


