【衡道丨干货】2024版CSCO胰腺癌指南更新,国内外权威共识指南中的胰腺癌的病理诊断有何异同?
时间:2024-09-01 06:00:46 热度:37.1℃ 作者:网络
胰腺癌病理学诊断
组织病理学和/或细胞学是确诊胰腺癌的唯一依据,应尽可能在抗肿瘤治疗前获得病理学检查结果。考虑临床实际情况,有时无法获得组织病理学或细胞学依据,可结合病史、临床表现、实验室检查和影像学检查,由MDT讨论后慎重做出临床初步诊断。如MDT不能做出一致性诊断时,建议动态观察,严密随访复查。
获取组织病理学和/或细胞学诊断的方法:
①手术活检是获取组织病理学诊断的可靠方法;
②穿刺活检术,对无法手术获得组织的患者,建议影像引导下经皮穿刺或超声内镜引导下穿刺,获得组织病理学或细胞学标本,对有转移病灶的患者,原发病灶获取和诊断困难,推荐对转移病灶活检;
③脱落细胞学检查,通过胰管细胞刷检、胰液收集检查、体腔积液检查等方法获得细胞病理资料。
鉴于胰腺癌患者获得标本困难,临床医师应与病理科医师讨论确定标准操作流程,以提高检测阳性率。
病理标本取材流程:


手术切除
拟行R0手术切除的患者,只要诊断依据(临床、实验室检查、影像学表现)充分,不需先获得病理学诊断支持。
TNM病理分期(pTNM)采用AJCC/UICC第8版。TNM前加前缀c、p、m、r和y,分别代表临床、组织病理学、多发性原发肿瘤、复发性肿瘤和治疗后肿瘤的TNM分期。
胰腺癌病理分期:


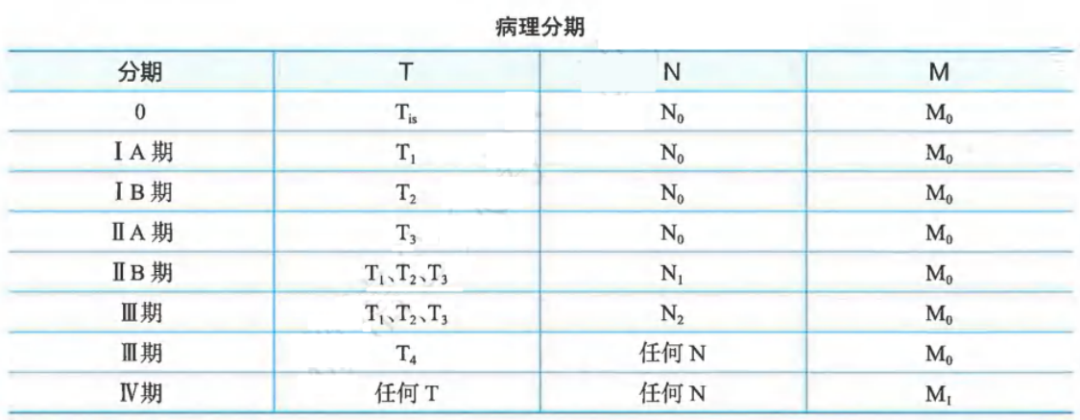
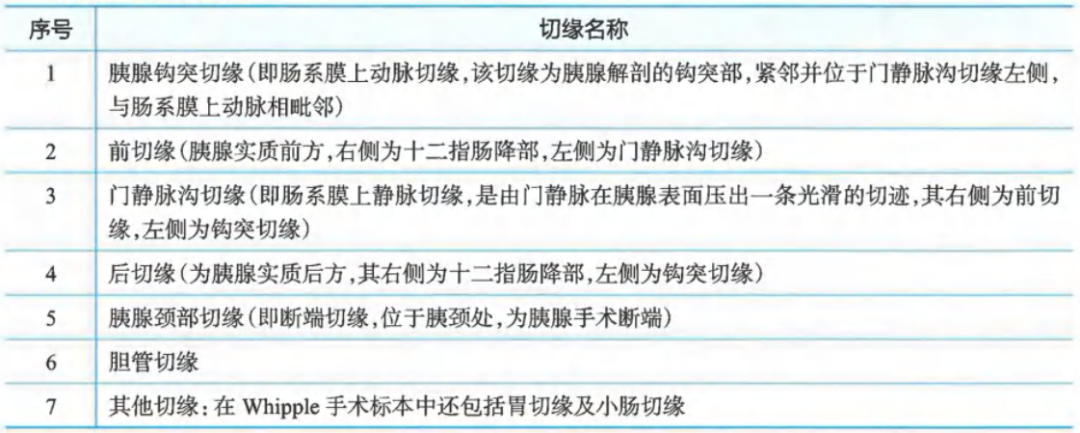
胰腺癌能否达到R0切除是影响胰腺癌预后的重要因素,国内外学界达成共识,切缘的肿瘤侵犯采用欧洲标准“1mm原则”作为判断R0切除的标准,即距离切缘1mm组织内如有肿瘤细胞浸润(≤1mm),为R1切除;距离切缘1mm组织内无肿瘤细胞浸润(>1mm),为R0切除;肉眼判断切缘阳性,为R2切除。
胰腺癌手术各切缘:
Ⅰ级推荐:
1.组织学类型
2.病理分级
3.病灶大小
4.肿瘤侵犯范围
5.有无脉管侵犯
6.有无神经侵犯
7.切缘情况
8.淋巴结情况
9.行BRCA1/2、PALB2、NTRK、NRG1和KRAS基因检测
10.行错配修复缺陷(dMMR)/微卫星不稳定(MSI)检测
-
胰腺癌组织学分型参考WHO消化系统肿瘤分类2019版。本指南仅适用于胰腺实质外分泌细胞起源的胰腺导管上皮腺癌,不包括神经内分泌肿瘤、淋巴瘤、转移瘤等恶性肿瘤和实性假乳头状瘤、囊腺瘤等良性或低度恶性肿瘤。
胰腺癌WHO组织学分型(2019):

-
如存在BRCA1/2或PALB2基因突变,可考虑使用含铂类的化疗。存在NTRK或NRG1基因融合的患者,相关靶向药物可能使患者获益。对存在dMMR/MSI-H的患者,使用靶向PD-1免疫检查点抑制剂可能使患者获益。但对于非dMMR/MSI-H胰腺癌患者,PD-1或PD-L1等免疫检查点抑制剂的应用,目前尚无充分循证医学依据。2020年ESMO年会报道,并于2022年发表的CCTG PA.7随机对照Ⅱ期临床研究(入组180例)结果显示,在未筛选的人群中,化疗联合免疫并未显著延长PFS和OS,有提高ORR和DCR的趋势。生物标志物分析发现KRAS野生型胰腺癌在免疫治疗中获益较显著。目前胰腺癌免疫治疗的联合模式和生物标志物仍在探索,期待更多临床研究结果。
-
错配修复缺陷(deficient mismatch repair,dMMR)首选蛋白检测,使用免疫组织化学方法检测MLH1、MSH2、MSH6和PMS2的表达,任何一个蛋白表达缺失为dMMR,4个蛋白均表达为错配修复功能完整(pMMR)。微卫星不稳定(microsatellite instability,MSI)建议采用NCI推荐的5个微卫星监测位点(BAT25,BAT26,D5S346,D2S123和D17S250)。判读标准:5个位点均稳定为微卫星稳定(MSS),1个位点不稳定为微卫星低度不稳定(MSI-L),2个及2个以上位点不稳定为微卫星高度不稳定(MSI-H)。DNA错配修复系统缺陷会造成微卫星不稳定情况。通常情况下,dMMR与MSI-H在生物学上具有一致性。
Ⅱ级推荐:
1.是否伴随胰腺炎
2.是否存在胰腺上皮内瘤变(PanIN)
3.行胚系和与治疗相关的体细胞突变基因检测
-
推荐所有确诊胰腺癌的患者接受胚系基因检测,使用检测遗传性肿瘤综合征的基因Panel。建议对可以进行抗肿瘤治疗的局部进展/转移性疾病患者进行肿瘤/体细胞基因谱分析以鉴定不常见的突变。考虑对与治疗相关的体细胞突变进行针对性检查,包括但不限于:基因融合(ALK、NRG1、NTRK、NGR1、ROS1)、基因突变(BRAF、BRCA1/2、HER2、KRAS G12C、PALB2)和错配修复缺陷(dMMR)(通过HC、PCR或NGS检测)。存在NTRK基因融合、NRG1基因融合或KRAS G12C基因突变患者,标准治疗失败后可考虑参加靶向NTRK、NRG1或KRAS G12C相关临床研究。推荐使用肿瘤组织进行检测,如果肿瘤组织检测不可行,可以考虑进行cfDNA检测。
Ⅲ级推荐:
1.检测PD-1和PD-L1表达
2.采用NGS进行多基因检测,评估TMB,了解有无潜在获益的治疗靶点
-
在标准治疗失败后,建议NGS检测,基于“篮式”研究思路,寻找可能使患者获益的潜在治疗靶点及相关靶向药物。同时评估TMB,了解是否可能从免疫治疗中获益。
穿刺活检术
Ⅰ级推荐:
1.明确病变性质和类型:肿瘤/非肿瘤、良性/恶性
2.组织学类型
3.肿瘤分化
4.鉴别诊断的免疫组化标记物
5.行BRCA1/2、PALB2、NTRK、NRG1和KRAS基因检测
6.行dMMR/MSI检测
Ⅱ级推荐:
行胚系和与治疗相关的体细胞突变基因检测
Ⅲ级推荐:
1.检测PD-1和PD-L1表达
2.采用NGS进行多基因检测,评估TMB,了解有无潜在获益的治疗靶点
细胞学
Ⅰ级推荐:
1.明确病变性质和类型:肿瘤/非肿瘤、良性/恶性
2.组织学类型
3.肿瘤分化
4.鉴别诊断的免疫组化标记物
5.行BRCA1/2、PALB2、NTRK、NRG1和KRAS基因检测
6.行dMMR/MSI检测
Ⅱ级推荐:
行胚系和与治疗相关的体细胞突变基因检测
Ⅲ级推荐:
1.检测PD-1和PD-L1表达
2.采用NGS进行多基因检测,评估TMB,了解有无潜在获益的治疗靶点
与NCCN指南比较
组织切片
-
切片的选择包括轴向、2片或多片以及垂直切片。一些病理医生通过沿胆管和胰管的放置探针,二等分胰腺标本,然后沿着胰腺的每一半连续切片。
-
轴向切片提供了肿瘤中心相对于壶腹、胆管、十二指肠、胰腺和上述提到的所有胰腺周围组织的全面评估。
-
目前,尚无对Whipple术后的标本进行切片的确切方法。但是,了解临床上可疑的病变有助于选择最佳的切片方法进行病变的检查和适当表征。标本切片最重要的是清楚和准确地评价切缘、肿瘤的大小以及与相关结构(例如胰腺表面、边缘、胆管、主胰管、十二指肠等)的关系。
-
根据当前的CAP协议,距离切缘≤1mm存在肿瘤定义为阳性切缘,尽管该建议主要基于直肠腺癌数据的外推。目前对于胰腺癌切除标本切缘多少为充分仍不明确。切缘的标准定义有助于对手术后患者选择何种辅助治疗进行更好的分类。例如,如果切缘小于1mm会导致不可接受的局部复发率明显升高,因此如果患者术前未接受放疗,则要强烈考虑行术后辅助放疗(RT)。对于所有邻近肿瘤的切缘(距离肿瘤≤1cm),应该以毫米为单位报告与肿瘤的间距。对于距肿瘤较远的切缘(距肿瘤>1.0cm),可以以厘米为单位报告与肿瘤的间距。与标本整块切除的邻近器官需要连续切片,不仅评价直接侵犯范围,也能检查转移病灶。需要一张切片证明肿瘤对器官的直接侵犯和/或独立的转移灶。
病理报告
1.肿瘤大小(通过仔细测量大体标本得到肿瘤最大径[cm],并在显微镜检查中证实)
2.组织学类型(H)
3.组织学级别(G[x-3])
4.原发肿瘤分期(T[x-4])
5.区域淋巴结(N[x-2])
找到的淋巴结总数
转移淋巴结的数目
6.转移(M[0-1])
7.切缘和其它环周表面:(应定义是否侵犯以及测量肿瘤距离切缘的距离[以mm为单位记录距离在1.cm以内边距])
(1)Whipple手术
肠系膜上动脉(腹膜后/沟突)切缘
胰腺后表面
SMV沟槽
胰颈(横断)切缘
胆管切缘
胃/肠切缘
胰腺前表面
(2)远端胰腺切除:
近端胰腺(横断)切缘
前(头侧)胰周(环周)表面
后(尾侧)胰周(环周)表面
8.淋巴脉管侵犯(L)
淋巴(小脉管)侵犯(可选)和血管(大脉管)侵犯(可选)
9.其它病理结果
胰腺上皮内瘤变
慢性胰腺炎
10.先前化疗和/或放疗后的肿瘤退缩分级
最终分期:T,N,M(按AJCC)
注:应尽一切努力找出胰腺手术切除标本内所有区域淋巴结。
病理学报告参考模板


参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胰腺癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Pancreatic Adenocarcinoma. Version 2.2024


