STTT 郑乐民/刘东辉/徐勇联合揭示ANXA1抑制脂肪生成的新机制
时间:2024-08-26 14:00:47 热度:37.1℃ 作者:网络
《柳叶刀》发布的最新研究报告显示,2022年全球肥胖症人口高达10亿多人。自1990年以来,全世界成年人肥胖症人数增加了一倍多,儿童和青少年肥胖症人数增加了三倍[1]。脂肪生成(Adipogenesis)是脂肪前体细胞特化为脂肪细胞谱系(即前脂肪细胞),积累营养并分化为成熟脂肪细胞的过程,是脂肪细胞增生的基础。司美格鲁肽作为肥胖的治疗药是过去一年全球最火热的药物。脂肪细胞的形成受到多种细胞外信号的影响。特定的信号配体,包括胰岛素、糖皮质激素和骨形态发生蛋白(BMPs),直接激活过氧化物酶体增殖物激活受体γ (PPARγ)和/或CCAAT/增强子结合蛋白α (C/EBPα),促进前脂肪细胞分化[2]。
膜联蛋白A1 (Annexin A1, ANXA1)是钙依赖性磷脂结合膜联蛋白超家族的成员,最初于1979年被鉴定为糖皮质激素的下游信号分子。郑乐民团队2022年发现ANXA1是一种新型内源性心血管保护剂,它可通过抑制血管平滑肌细胞表型转换来预防急性主动脉夹层(Cardiovasc Res)[3];2021年发现ANXA1可通过影响代谢改善糖尿病肾病(Kidney Int;Diabetes)[4-5]。据报道,ANXA1在肥胖儿童和喂食高脂肪饮食的小鼠的脂肪组织中显著增加。此外,利用重组人ANXA1治疗可降低此类小鼠的体重。这些发现表明,ANXA1在调节肥胖和与肥胖相关的代谢疾病中起着重要作用。然而,目前关于ANXA1抗肥胖作用的大多数研究都是基于其抗炎特性,并侧重于内皮细胞和炎性细胞。这些研究没有考虑ANXA1对脂肪生成的直接作用,其潜在的分子机制尚不清楚。
2024年8月23日,北京大学心血管研究所、北京大学血管稳态与重构全国重点实验室郑乐民教授团队联合广州市第一人民医院刘东辉教授和西南医科大学徐勇教授团队,共同合作在Signal Transduction and Targeted Therapy杂志上发表题为“Annexin A1 binds PDZ and LIM domain 7 to inhibit adipogenesis and prevent obesity”的研究论文。该研究报告了ANXA1通过与MYC Binding Protein 2 (MYCBP2)竞争性结合PDZ And LIM Domain 7 (PDLIM7)进而影响SMAD Family Member 4 (SMAD4)泛素化蛋白酶体降解和脂肪生成进程的新机制,揭示了该通路在抗肥胖功能的潜在治疗策略,并提出ANXA1模拟肽进行抗肥胖治疗的可能性。

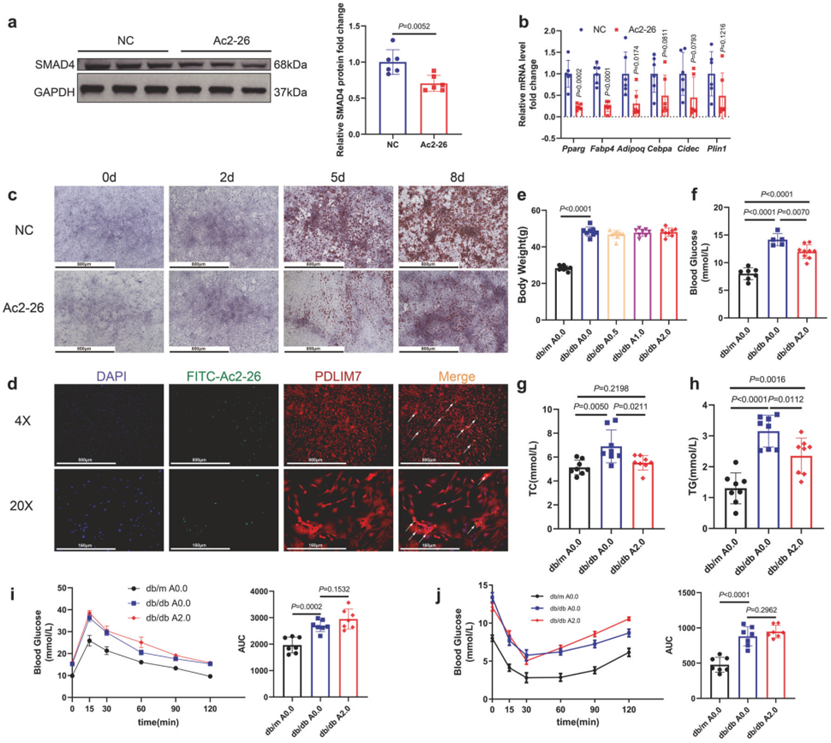
本研究首先通过公开数据库搜索和对人体及小鼠皮下脂肪组织(SAT)的检测,发现ANXA1在肥胖群体的SAT中异常升高,而在其他组织中没有显著改变。之后,通过对ANXA1全身性缺失小鼠、脂肪组织特异性缺失小鼠和全身过表达小鼠的检测,进一步确定了脂肪组织中ANXA1对肥胖的抑制作用。
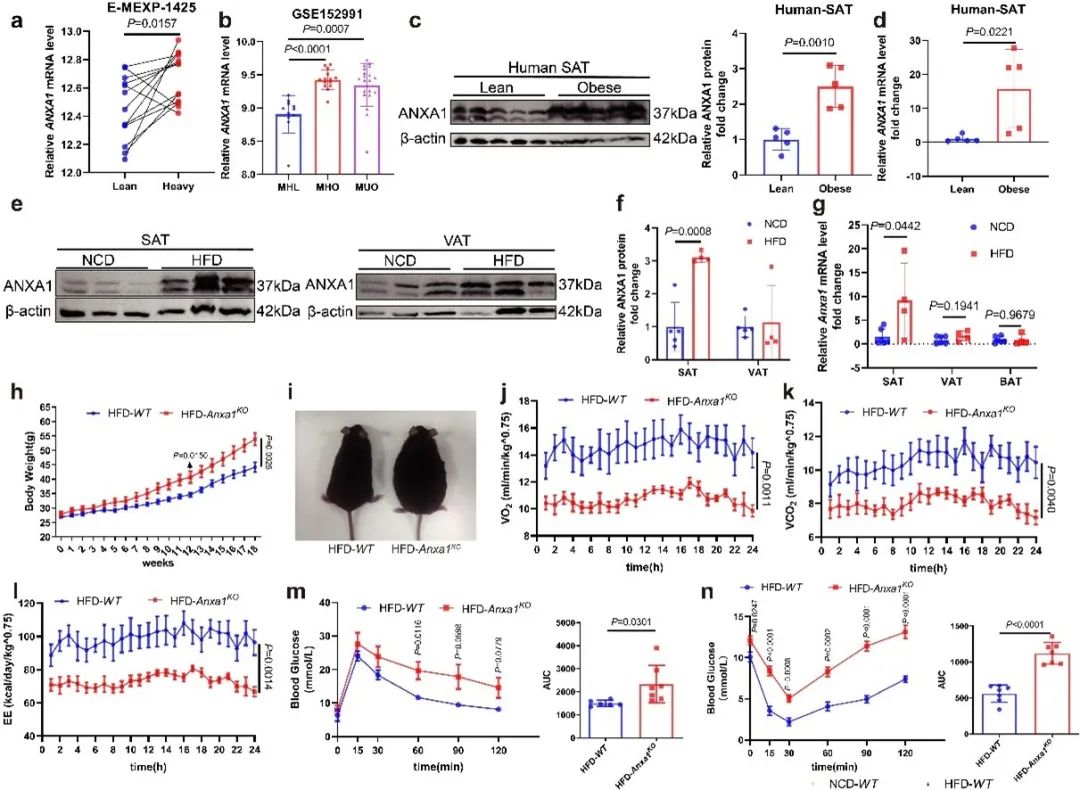
作者通过对脂肪组织来源的血管基质细胞(SVFs)的进一步基因检测发现,ANXA1显著抑制PPARγ的表达,并通过分化诱导实验确定ANXA1显著抑制脂肪前体细胞的分化潜能。通过对PPARγ相关脂肪生成通路的上游靶点筛选,作者最终确定ANXA1通过抑制SMAD4与PPARγ启动子区域的结合来下调PPARγ的转录表达。
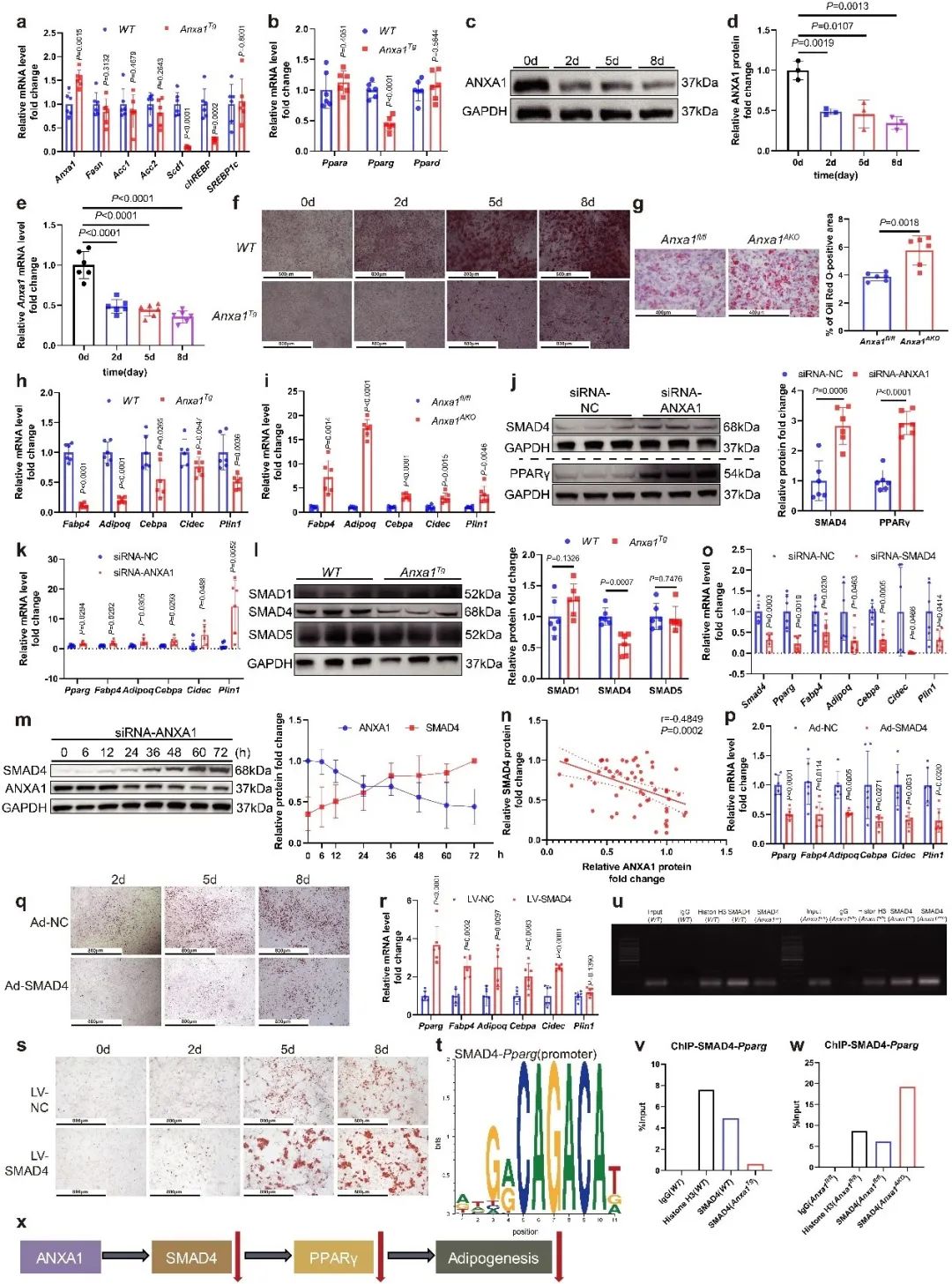
但ANXA1并未影响SMAD4的mRNA含量,作者通过泛素化检测发现,沉默ANXA1可能抑制SMAD4的泛素化水平。为了进一步确定ANXA1抑制SMAD4的分子机制,研究团队对与ANXA1相互作用的蛋白质进行了蛋白质组学分析。首先利用免疫共沉淀的方法,获得了与ANXA1相互作用的蛋白质,再通过高效液相-质谱/质谱联用的方法,对与ANXA1相互作用的蛋白质进行了分析筛选,确定并验证了ANXA1与PDLIM7的直接相互作用,并证实了此种蛋白相互作用促进了SMAD4的K48泛素化蛋白酶体降解。使用慢病毒过表达PDLIM7,能够增强SVFs的分化潜能。
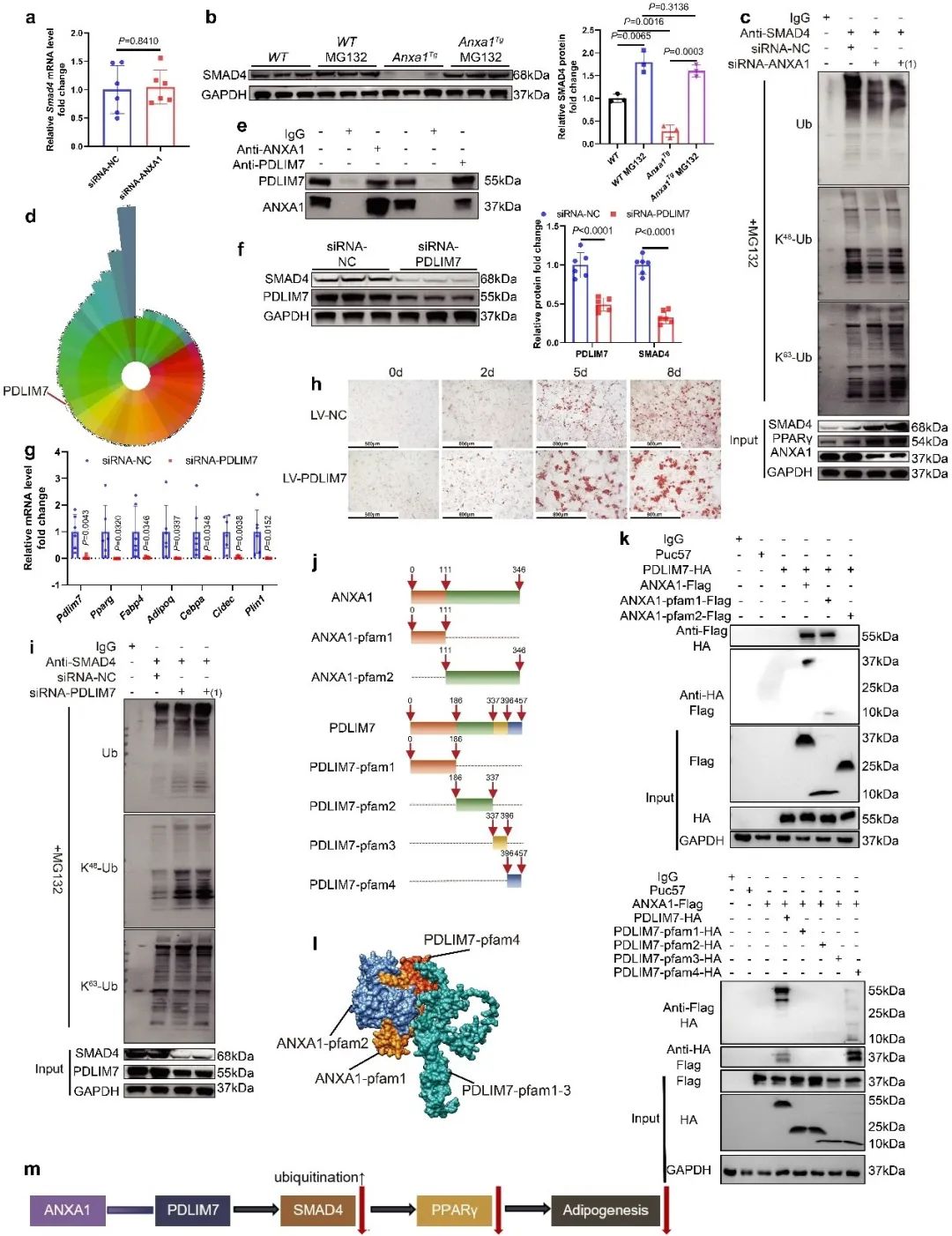
通过另一个蛋白质组学分析,团队发现PDLIM7并未直接介导SMAD4的泛素化,而是通过结合另一个E3泛素连接酶MYCBP2发挥作用。沉默MYCBP2下调了SMAD4的K48泛素化;使用腺病毒敲低MYCBP2增强了SVFs的分化潜能。具体而言,ANXA1与MYCBP2竞争与PDLIM7的相互作用。这暴露了MYCBP2结合位点,使其更容易与SMAD4结合,并促进其泛素化蛋白酶体降解。SMAD4降解下调PPARγ转录,并减少脂肪生成。
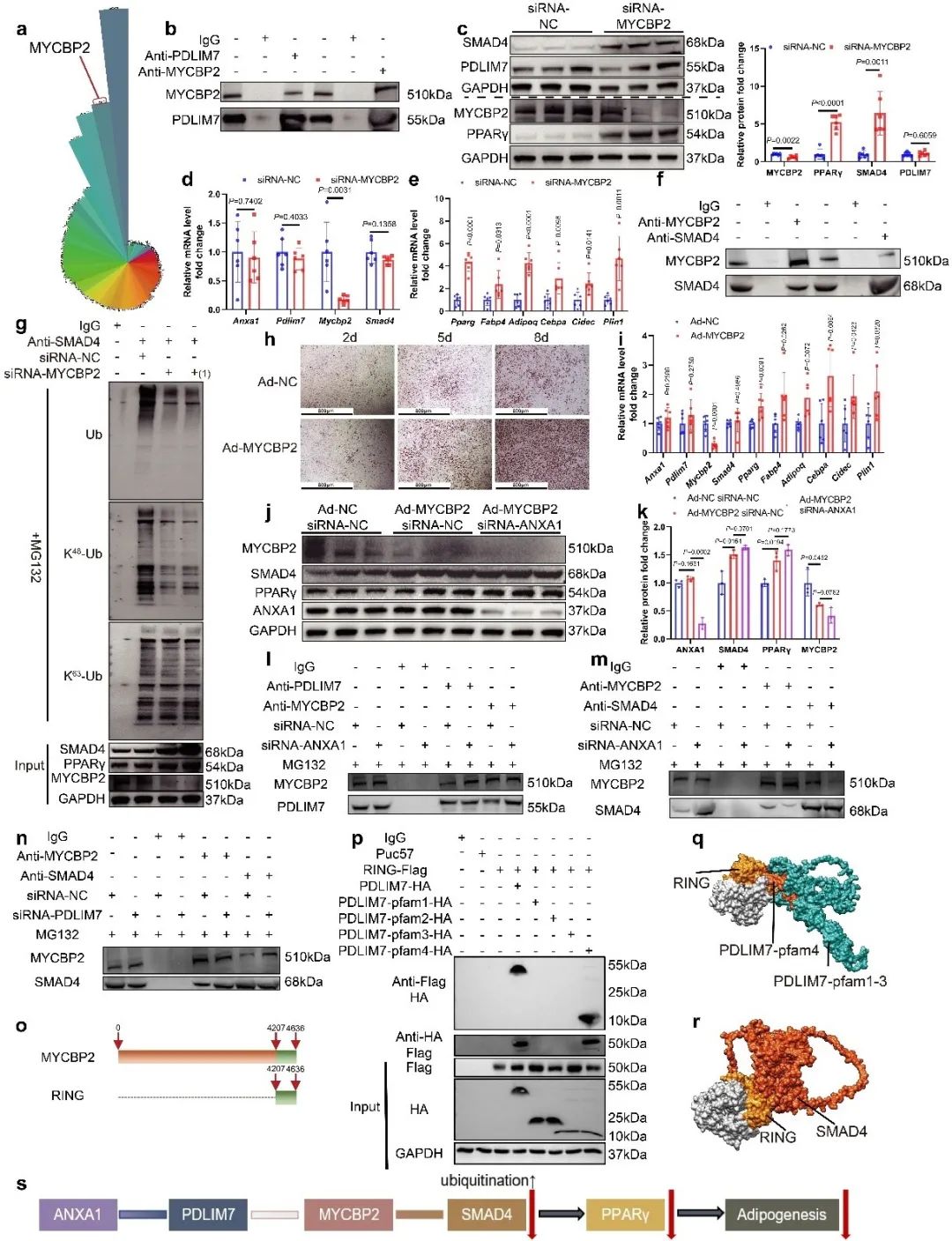
最后,团队探索了ANXA1活性N-末端肽Ac2-26在细胞模型和小鼠肥胖模型上进一步验证了Ac2-26可通过与PDLIM7相互作用抑制脂肪生成和肥胖。
综上,这些发现确立了脂肪前体细胞中ANXA1-PDLIM7-MYCBP2-SMAD4-PPARγ通路在脂肪生成中的重要作用,提出了通过补充ANXA1活性片段是一种潜在的抗肥胖策略,通过减缓脂肪生成,以对抗肥胖相关的代谢性疾病。
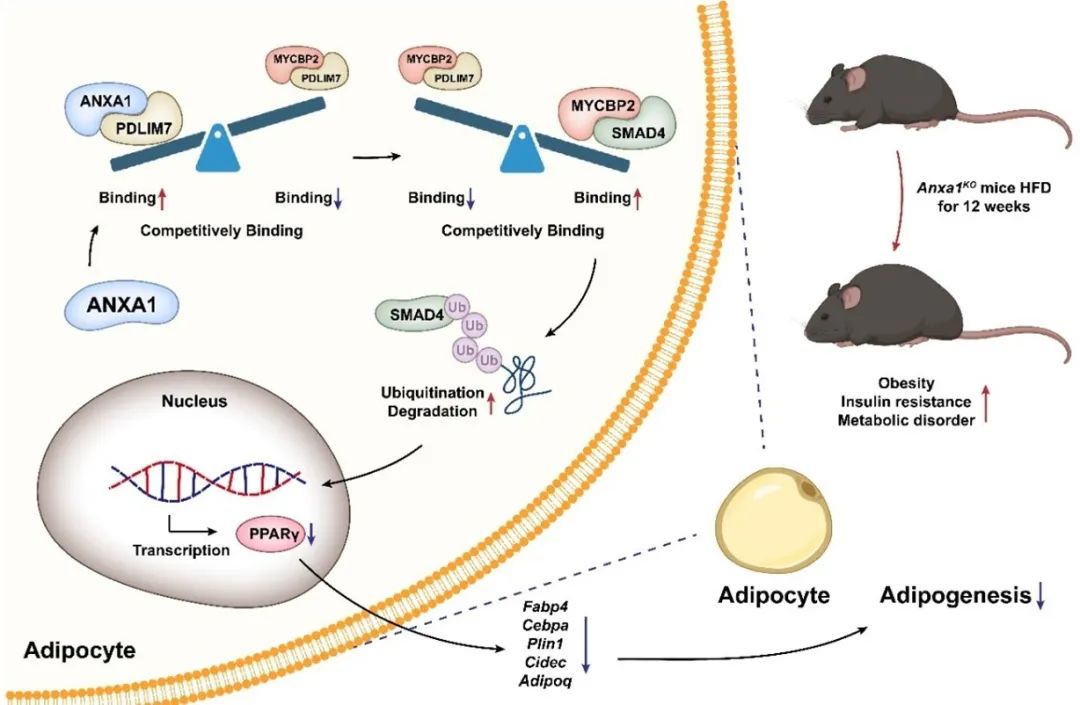
ANXA1-PDLIM7-MYCBP2-SMAD4-PPARγ通路示意图
北京大学基础医学院八年制房璐与广州市第一人民医院助理研究员刘昌杰(北京大学基础医学院八年制毕业生)为共同第一作者,北京大学基础医学院郑乐民教授、广州市第一人民医院刘东辉教授、西南医科大学附属医院徐勇教授为并列通讯作者。本研究由国家重点研发计划项目、国家自然科学基金、北京市自然科学基金海淀原始创新联合基金项目和京津冀基础研究合作专项项目主要支持。
参考文献:
[1] NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in underweight and obesity from 1990 to 2022: a pooled analysis of 3663 population-representative studies with 222 million children, adolescents, and adults. Lancet. 2024 Mar 16;403(10431):1027-1050.
[2] Ghaben AL, Scherer PE. Adipogenesis and metabolic health. Nat Rev Mol Cell Biol. 2019 Apr;20(4):242-258.
[3] Zhou C, Lin Z, Cao H, Chen Y, Li J, Zhuang X, Ma D, Ji L, Li W, Xu S, Pan B, Zheng L. Anxa1 in smooth muscle cells protects against acute aortic disp. Cardiovasc Res. 2022 May 6;118(6):1564-1582.
[4] Wu L, Liu C, Chang DY, Zhan R, Sun J, Cui SH, Eddy S, Nair V, Tanner E, Brosius FC, Looker HC, Nelson RG, Kretzler M, Wang JC, Xu M, Ju W, Zhao MH, Chen M, Zheng L. Annexin A1 alleviates kidney injury by promoting the resolution of inflammation in diabetic nephropathy. Kidney Int. 2021 Jul;100(1):107-121.
[5] Wu L, Liu C, Chang DY, Zhan R, Zhao M, Man Lam S, Shui G, Zhao MH, Zheng L, Chen M. The Attenuation of Diabetic Nephropathy by Annexin A1 via Regulation of Lipid Metabolism Through the AMPK/PPARα/CPT1b Pathway. Diabetes. 2021 Oct;70(10):2192-2203.
原文链接:
https://www.nature.com/articles/s41392-024-01930-0


