专家论坛|杨涛:中草药相关肝损伤的物质基础及其毒性机制
时间:2024-08-23 22:00:43 热度:37.1℃ 作者:网络
中药具有多成分、多靶点、多途径的作用特点,肝脏作为药物代谢的重要器官,是中药不良反应发生的主要部位之一。中草药相关肝损伤是中药安全性的重要内容,有其重要物质基础与毒性机制。物质基础包括药源性成分与非药源性物质,药源性成分是指中药本身或在体内经代谢产生的具有潜在肝损伤作用的成分,以生物碱、萜类、蒽醌类和苯丙素类为主,部分存在于动物药与矿物药中;非药源性物质是指除了中药本身及其代谢产物以外的其他能够引起肝损伤的物质,这些物质大多来源于中药种植、加工、储存环节,包括重金属和真菌等。本文归纳综述近年来中草药相关肝损伤的物质基础与毒性机制相关进展,以期为深入了解中草药相关肝损伤的作用原理提供参考。
1药源性主要成分与机制
1.1 生物碱类
生物碱类化合物是中草药中具有重要药理活性的一类成分,但一些生物碱也会对肝脏造成明显损伤。具有毒性的生物碱包括吡咯里西啶生物碱(PA)、吲哚类生物碱、乌头类生物碱、莨菪烷类生物碱和异喹啉类生物碱,其中PA和吲哚类生物碱是引起肝损伤的主要类型。
PA由两个吡咯烷共用一个氮原子稠合而成,可分为饱和型与不饱和型,其中具有C-1,C-2不饱和双键结构的PA肝损伤作用较强,也称为肝毒性PA,是最常见的引起肝损伤的生物碱,常见于紫草科、菊科和豆科等植物中,临床上易导致肝窦阻塞综合征。天然形式的PA通常无毒,但在CYP3A酶的作用下发生生物转化后,其代谢物与蛋白质或核酸发生反应,产生毒性。千里光碱是含有肝毒性PA的中草药如千里光、菊三七、款冬等共有的一种生物碱,其毒性反应较强。在肝脏中,千里光碱由CYP450酶代谢生成脱氢吡咯,与DNA、蛋白质等生物大分子结合,损伤肝窦内皮细胞,导致肝窦阻塞,引发肝损伤。使用CYP3A4抑制剂利托那韦后,可以显著改善菊三七诱导的大鼠肝损伤。千里光碱还能诱导小鼠肝细胞中Caspase-3酶活性增强以及抗凋亡蛋白Bcl-xL的减少,从而触发线粒体介导的细胞凋亡。Zuckerman等通过体外实验发现,低浓度的PA会诱导细胞骨架凋亡和异常,而高浓度时则直接导致细胞坏死。此外,代谢组学与基因组学的研究发现,千里光碱诱导的肝损伤大鼠中,胆汁酸代谢稳态发生改变,CYP7A1和胆汁酸辅酶A:氨基酸N-乙酰转移酶等胆汁酸代谢相关基因下调。千里光中的阿多尼弗林碱、千里光菲林碱,款冬花中的克氏千里光碱也属于PA,对肝脏可造成不同程度的损伤。PA还具有潜在的基因毒性,其水溶性与基因毒性呈正相关,水溶性越大,分子表面积越小,相应的基因毒性效应就越显著。
吲哚类生物碱结构复杂,马钱子中的士的宁、马钱子碱以及吴茱萸中的吴茱萸碱、吴茱萸次碱均属于此类生物碱。士的宁和马钱子碱既是药效成分也是毒性成分,其治疗剂量与中毒剂量相近。研究发现,士的宁的毒性是马钱子碱的10倍以上。CYP450酶系中的多种代谢酶如CYP1A1、CYP2C9和CYP3A4等均参与士的宁的代谢,其中CYP3A4酶催化氮氧化反应,生成的代谢产物士的宁氮氧化物毒性较小且具有良好的生物活性。斑马鱼的代谢组学研究表明,马钱子的肝毒性与氨基酸和脂肪酸等代谢紊乱密切相关。马钱子碱的肝毒性还表现出昼夜节律,这与肝脏CYP3A11的昼夜节律波动有关。吴茱萸次碱在CYP450酶的催化下转化为高活性的代谢物,这些代谢物能够共价结合酶的催化位点,从而基于机制性抑制酶的活性。几种代表性的生物碱类化合物及其肝损伤成分见图1。
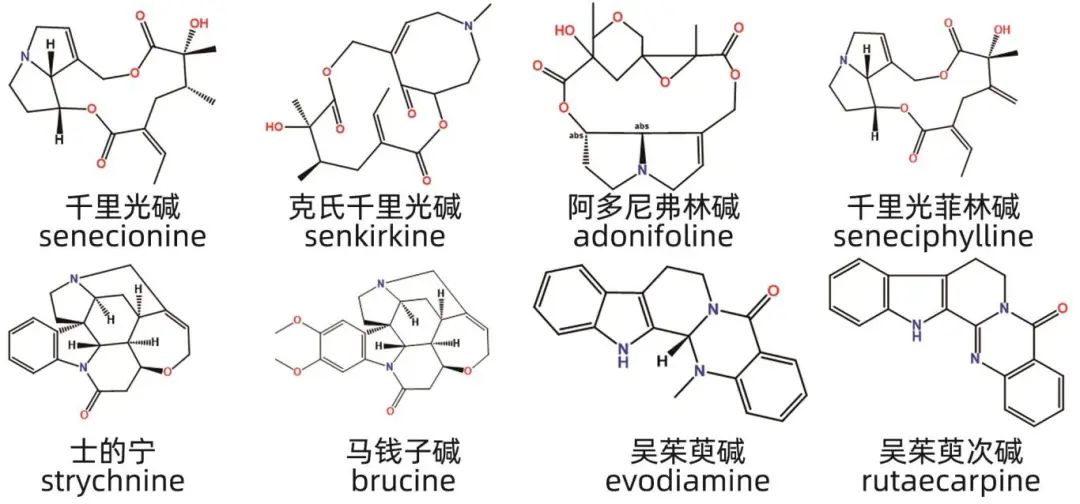
图1 生物碱类化合物代表性肝损伤成分
1.2 萜类
萜类化合物是一类以异戊二烯为基本结构单元的化合物及其衍生物,根据异戊二烯的数目可分为半萜、单萜、倍半萜、二萜等。二萜常以内酯或苷的形式存在,广泛分布于自然界中的挥发油、树脂和色素中,是中草药中的重要生物活性物质。雷公藤及其制剂常用于治疗类风湿性关节炎等自身免疫性疾病,但其具有多器官毒性,尤其是肝毒性,限制了临床应用。雷公藤中的毒性成分主要为二萜、三萜类和生物碱类化合物,具有环氧二萜内酯结构的雷公藤甲素是主要药效和毒性成分。研究表明,雷公藤甲素通过破坏肝脏免疫平衡、诱发氧化应激、改变肠道菌群和肝药酶代谢异常等途径引起肝损伤。在雷公藤甲素肝毒性模型中,TLR4-MYD88-NF-κB通路的激活和氧化应激共同促进NOD样受体蛋白3炎症小体过度活化,导致炎症因子IL-1β大量释放,增加中性粒细胞和巨噬细胞向肝脏募集,从而加剧肝损伤。此外,雷公藤甲素以浓度依赖性方式抑制线粒体呼吸链,导致线粒体活性氧生成增加,并上调线粒体动力相关蛋白1,引起ATP与线粒体DNA拷贝数减少,导致线粒体功能障碍。研究还发现,肠道菌群介导雷公藤甲素的肝损伤,在大鼠肠内容物与雷公藤甲素共同孵育后,雷公藤甲素含量随时间延长而下降,至24 h时仅剩45%,并且使用抗生素清除肠道菌群后,再给予雷公藤甲素,肝损伤比单独给予雷公藤甲素更为严重。雷公藤中的三萜类成分如雷公藤红素和雷公藤内酯甲也具有肝损伤效应。栀子的成熟果实是一种药食同源的中药,具有保肝和致肝损伤的双重作用。其环烯醚萜苷类成分栀子苷(京尼平苷)在肝损伤修复中发挥作用,但高剂量时会导致大鼠血清ALT、AST和TBil水平升高,并引起肝脏肿胀、坏死和炎症细胞浸润等病理变化。京尼平苷在体内经β-葡萄糖苷酶水解产生京尼平,该化合物对HepG2细胞有明显毒性,毒性机制研究显示氧化应激导致的线粒体损伤是京尼平肝毒性的重要途径。黄药子中的黄毒素B是一种二萜内酯类成分,具有剂量依赖性的肝毒性,被认为是黄药子肝毒性的主要物质基础。柴胡中的三萜皂苷成分柴胡皂苷A和柴胡皂苷D也被证实具有肝损伤作用。图2展示了几种代表性的萜类化合物及其肝损伤成分。
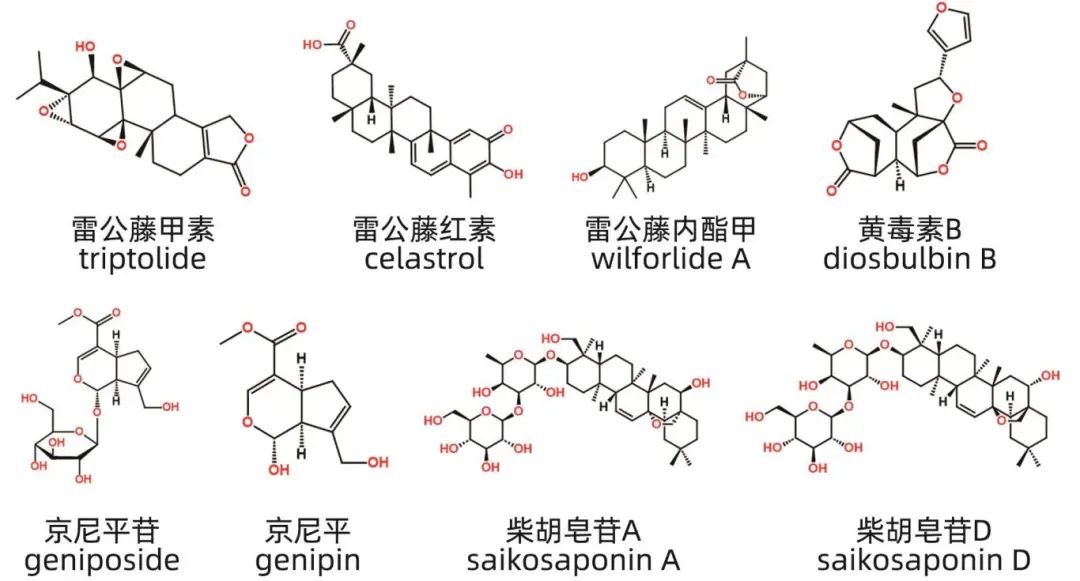
图2 萜类化合物代表性肝损伤成分
1.3 蒽醌类
蒽醌是一类具有9,10-二氧杂蒽核结构的芳香族化合物,广泛分布于蓼科、豆科、茜草科、百合科等中草药中,如大黄、何首乌、虎杖、决明子、紫草和芦荟等。根据结构,蒽醌可分为单蒽核类和双蒽核类,单蒽核类又可根据羟基的位置分为大黄素型(羟基在两侧苯环)和茜草素型(羟基在一侧苯环)。蒽醌类化合物具有抗炎、抗氧化和抗癌等多种生理功能。尽管大黄酸、大黄素和芦荟大黄素等蒽醌成分具有显著的泻下作用和抗癌活性,但在高剂量使用时也可能引起肝损伤。何首乌是一种传统的补益药,但近年来其引起的不良反应,尤其是肝损伤的报道逐渐增多。何首乌的化学成分复杂,其中蒽醌类(如芦荟大黄素、大黄酸、大黄酚和大黄素-8-甲醚等)被认为是主要的肝损伤物质。研究表明,大黄素-8-O-β-D-葡萄糖苷、大黄素、大黄酸和大黄素型单蒽酮等成分可以显著抑制大鼠原代肝微组织的增殖,且毒性依次增加。大黄素和芦荟大黄素能够抑制人肝细胞中细胞色素氧化酶CYP2D6的表达,降低CYP2D6活性,从而加重肝细胞毒性。此外,蒽醌类成分可能通过抑制CYP450酶的活性,导致药物在肝脏中蓄积,进而引发肝损伤。例如,芦荟大黄素对斑马鱼CYP3A4酶的活性有显著抑制作用,并能上调Caspase-3的表达,诱导细胞凋亡。最新研究发现,何首乌引起的特异质性肝损伤可能与遗传背景相关,HLA-B*35∶01基因可以作为何首乌肝损伤易感人群的生物标志物。蒽醌类化合物的代表性肝损伤成分见图3。
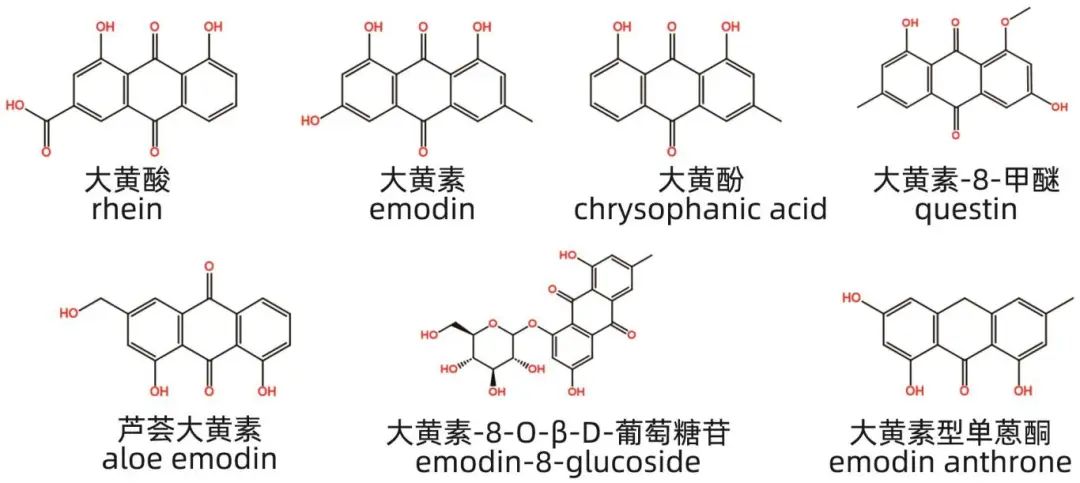
图3 蒽醌类化合物代表性肝损伤成分
1.4 苯丙素类
苯丙素类化合物是一类以C6-C3为基本结构单元的化合物,常见于植物中,具有抗肿瘤、抗氧化和抗菌等生理活性。其主要类型包括简单苯丙素类、香豆素类和木脂素类。细辛是一种具有解表散寒、祛风止痛功效的中药,药用部位为马兜铃科植物的根或根茎。黄樟醚是细辛中的主要毒性成分,属于简单苯丙素类,具有呼吸麻痹作用和潜在致肝癌风险。研究表明,黄樟醚的毒性与ALT、AST血清含量变化一致,显示出剂量依赖性,并且其肝损伤与氧化应激有关,抗氧化剂如维生素E可以减轻肝损伤,而谷胱甘肽合成抑制剂则会加重肝损伤。黄樟醚在体内经CYP450酶代谢生成多种代谢产物,如1,2-二羟基-4-烯丙基苯、3’-羟基黄樟素、1’-羟基黄樟素和黄樟素2’,3’-环氧物,这些代谢产物可能介导其肝毒性。此外,细辛中的甲基丁香酚和肉豆蔻醚也具有肝损伤作用。补骨脂是一种传统的补肾壮阳中药,具有抗肿瘤、抗炎和神经保护等多种活性。其有效成分补骨脂二氢黄酮甲醚能够促进肝再生,保护高脂饮食诱导的非酒精性脂肪肝,蛋白质组学研究发现其保肝作用靶点为增殖细胞核抗原。尽管补骨脂传统上被认为无毒,但近年来有研究报道其肝毒性,特别是其中的呋喃香豆素类成分如补骨脂素和异补骨脂素对大鼠、小鼠和斑马鱼都有一定的肝毒性。体外实验发现,补骨脂素和异补骨脂素以时间和剂量依赖性的方式诱导HepG2细胞和小鼠肝损伤,可能与芳香烃受体核转位后诱导的CYP1A2基因转录有关。代谢组学研究显示,给予大鼠60 mg/kg补骨脂素连续7天后,可引起氨基酸代谢紊乱,特别是缬氨酸、亮氨酸和异亮氨酸的生物合成途径紊乱,病理学结果也显示肝脏是主要的靶器官。苯丙素类化合物的代表性肝损伤成分见图4。
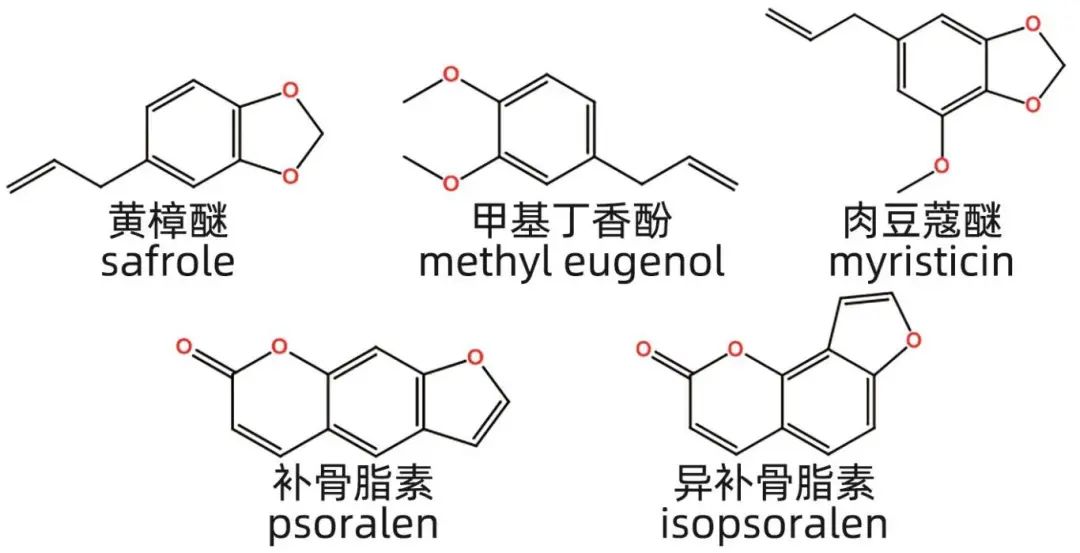
图4 苯丙素类化合物代表性肝损伤成分
1.5 毒蛋白与重金属
植物和动物药中的毒蛋白与糖苷类成分,以及矿物药中的汞、铅、砷等重金属,也有报道显示其可能导致肝损伤。蓖麻子是大戟科植物蓖麻的种子,其中的蓖麻毒素是一种强烈的糖蛋白毒素,由A、B两条肽链通过二硫键连接而成。B链与细胞膜表面受体结合后进入细胞,释放出具有核糖体抑制活性的A链,导致细胞因核糖体降解而死亡。其他如相思子、望江南子、巴豆、苍耳子等植物药,以及蜈蚣和蝮蛇等动物药中的毒蛋白,也能引起肝损伤。朱砂是一种天然辰砂矿石,具有重镇安神的功效,常用于朱砂安神丸、安宫牛黄丸和柏子养心丸等中成药。朱砂中的毒性成分主要为硫化汞和微量可溶性汞,汞可以在肝脏中蓄积,抑制药物代谢酶的活性,从而引起肝脏毒性反应。
2非药源性物质与机制
除了中药本身的成分外,一些外源性有害物质也可能在中药的种植、加工、运输和储存过程中引起药物变质,成为中药肝损伤的重要因素。这些外源性有害物质主要包括农药残留、二氧化硫残留、重金属、真菌毒素和植物生长调节剂。相比药源性肝损伤物质,这些有害物质往往在体内蓄积到一定浓度后才表现出毒性,具有隐蔽性强、复杂且通常为痕量级别等特点,检测难度较大,缺乏规范的限量与检测标准,严重影响中药的安全性。
2.1 农药残留
农药残留主要包括有机磷类、有机氯类、拟除虫菊酯类和氨基甲酸酯类。农药残留的原因主要包括:种植过程中农药滥用、水源、空气、土壤中的农药残留,采收、加工、运输过程中的污染,以及食物链的传递。例如,中药地龙和水蛭由于其生长特性和环境容易受到农药残留的影响,服用后可能通过食物链间接摄取农药残留,导致肝损伤。有机氯类农药因其半衰期长、脂溶性强,易在肝脏中蓄积,导致肝损伤;而氨基甲酸酯类农药可能通过诱导氧化应激损害肝脏。
2.2 二氧化硫残留
中药通过硫磺熏蒸可利于存储和保持药效,但熏蒸过程中产生的二氧化硫对身体有害。在空气湿度大的情况下,二氧化硫与水和氧气反应生成亚硫酸,可能导致中药变色、变味,使用这些中药可能对肝脏和肾脏造成损害。研究显示,被硫磺熏蒸的怀牛膝饮片中二氧化硫含量超标,长期食用可能引起肝肾毒性。
2.3 重金属
中草药中的重金属残留一般来源于环境污染的水源、土壤、空气,或炮制过程中的容器与辅料,在全草、果实、种子类中药中检出量最高。重金属摄入后,会在体内蓄积,通过肝脏和肾脏代谢和排泄,长期积累可能导致肝肾功能受损,严重时可引发急性肝衰竭或肾衰竭。研究表明,铅、镉等重金属可以通过消化道、呼吸道和皮肤进入体内,并在肝、肾、肺等器官中长期蓄积,引发疾病。例如,黄丹和砒霜等药物中的铅、镉可能导致血铅、血镉升高,并表现出肝损伤。
2.4 真菌毒素
真菌毒素是具有毒性的次级代谢产物,在中药种植、生长、加工、炮制和储存运输过程中可能产生,对肝脏危害极大。中药未能及时干燥、储存不当或受其他外界条件影响时,易发生霉变,受到黄曲霉毒素污染。黄曲霉毒素是世界卫生组织划定的Ⅰ类致癌物,可导致肝癌甚至死亡。在检测当归、苦杏仁和金银花等15个品种、45批中药饮片的真菌毒素污染时,发现其中20批样品含有黄曲霉毒素,检出率高达44.4%。此外,展青霉素、赭曲霉毒素等真菌毒素也会导致肝损伤。
2.5 植物生长调节剂
植物生长调节剂是一种新型激素类农药,可促进中药植物生长发育和提高品质,主要包括生长素类、赤霉素类、细胞分裂素类、乙烯、脱落酸、甾醇类和生长抑制物质。虽然多数植物生长调节剂毒性较低,但常存在不规范使用现象,其毒性机制尚不明确。研究发现,多效唑会以时间和剂量依赖性的方式抑制HepaRG细胞活力,诱导细胞凋亡和氧化应激。网络药理学和代谢组学研究显示,多效唑的肝肾毒性与色氨酸代谢、花生四烯酸代谢、亚油酸代谢和嘌呤代谢途径有关,CYP1A2、CYP2A6、CYP2E1、MAOA、PLA2G2A、PTGS1和XDH可能是其关键作用靶点。
3中草药肝毒性物质基础研究难点与未来展望
尽管中草药肝毒性物质基础与毒理机制的研究取得了一定进展,但仍面临许多挑战。中草药相关肝损伤的物质基础和毒性机制研究中,存在成分复杂、多重机制、个体差异、研究方法局限性以及数据匮乏等难点。
中草药的毒性成分复杂多样,既包括中草药本身的主要成分,也包括因不同的提取方法、加工方式和种植条件引入的外源性毒性物质。此外,中草药的毒性往往不是由单一成分引起的,而是多种成分之间的协同作用。这种协同作用可能表现为相互增强毒性或中和毒性,增加了研究的复杂性和不确定性。中草药肝毒性的机制也非常复杂,涉及多种毒性机制,包括但不限于氧化应激、细胞凋亡、免疫反应和炎症反应等多重因素,这些机制之间可能存在交互作用和累积效应,使得毒理机制难以明确。机体的个体差异是另一个难点。遗传因素、代谢状态和健康状况等因素会导致个体对中草药毒性反应的不同,进一步增加了研究的难度。当前的毒性物质研究方法在敏感性和特异性上存在局限性。虽然动物模型和体外实验有助于初步研究,但其结果并不完全适用于人类。传统研究方法难以高效筛选和鉴定复杂混合物中的毒性成分。尽管高通量筛选和多组学研究等新技术展现出巨大潜力,但其在中草药毒性研究中的应用仍处于初步阶段。中草药相关肝损伤的数据匮乏和临床报告的不完善也是一大挑战。临床报告和病例资料常常不完整或不标准化,这严重限制了毒性成分和毒性机制证据链的建立。解决这些问题需要发展更为精准有效的研究方法,积累更系统和完善的数据资料,并加强跨学科和国际间的合作。
总之,中草药相关肝损伤的内源性成分和外源性因素及其相关作用机制研究已取得显著进展,但仍存在一些研究难点与问题。需要加强标准化建设和新技术的应用,以深入探究中草药肝毒性的物质基础及其内在机制。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCH240802



