南方医科于梦/中山大学孙逸仙纪念医院段小慧团队Small:双金属电敏剂通过缓解自噬诱导的ROS耐受和免疫抑制改善ROS抗肿瘤治疗
时间:2024-08-23 16:00:42 热度:37.1℃ 作者:网络
近年来,通过内源性或外源性刺激产生活性氧(ROS)的抗肿瘤策略已经显示出有效杀伤实体肿瘤的能力,包括光动力治疗、放疗动力学治疗、声动力治疗、电动力治疗和化学动力学治疗等等。此外,基于ROS的抗肿瘤策略可通过释放损伤相关分子模式来触发氧化应激和诱导免疫原性细胞死亡(ICD)效应,从而有效地促进免疫反应。其中,电动力治疗通过分解生物体内大量存在的水分子来产生ROS,从而杀死肿瘤细胞,这在治疗处于乏氧微环境的肿瘤中显示出巨大的潜力。
然而,研究发现,基于ROS的单一治疗方式通常疗效不佳,主要是因为治疗过程中产生的ROS还会激活肿瘤细胞的保护性自噬,不但降低肿瘤细胞对ROS诱导的损伤的敏感性,而且引起免疫耐受,进而对依赖于ROS治疗的抗肿瘤策略产生耐药性。
2024年7月30日,南方医科大学药学院于梦/中山大学孙逸仙纪念医院段小慧团队在《Small》杂志在线发表了题目为“A Bimetallic Electro-Sensitizer Improves ROS Therapy by Relieving Autophagy-Induced ROS Tolerance and Immune Suppression”的工作。该研究设计了双金属复合纳米粒子,负载自噬抑制剂氯喹(Pt-Ir-CQ NPs)作为电敏剂,通过抑制自噬和激活抗肿瘤免疫反应来增强电毒性的治疗,在治疗乏氧和免疫抑制肿瘤方面显示出独特的优势。

【双金属电敏剂通过自噬抑制增强电毒性的抗肿瘤效应】
在本研究中,研究人员旨在实现高效的ROS治疗,消除实体肿瘤组织,抑制残留肿瘤。为了解决这个问题,研究人员设计并构建了一个电敏剂Pt-Ir-CQ NPs。在电场驱动下,电敏剂Pt-Ir-CQ NPs,在乏氧肿瘤微环境中,依靠水分子产生大量ROS而产生电毒性,杀死肿瘤细胞。同时,Pt-Ir-CQ NPs中CQ的自噬抑制作用在治疗过程中发挥了至关重要的作用,不仅通过抑制肿瘤细胞的保护性自噬,提高了肿瘤细胞对ROS的敏感性,增强了ROS产生的电毒性损伤,而且还促进了肿瘤内免疫原性细胞的浸润,激活抗肿瘤免疫应答,并与电毒性诱导的ICD效应协同作用,为治疗乏氧和免疫抑制性肿瘤提供了新的策略。
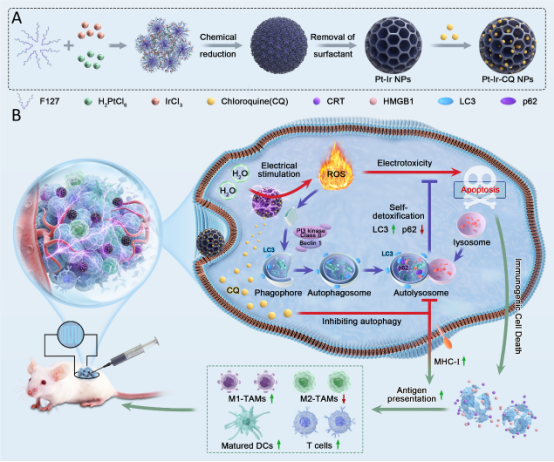
图1 Pt-Ir-CQ NPs的制备及其缓解自噬诱导的ROS耐受和免疫抑制的示意图。
【双金属电敏剂干扰自噬流】
自噬对促进肿瘤细胞在应激情况下的生存能力方面起着至关重要的作用。研究人员通过荧光显微镜、生物电镜以及蛋白免疫印迹实验来观察不同处理对于自噬流的影响。实验发现,在进行电毒性治疗(Pt-Ir + E)时,自噬体和自噬溶酶体的数量增加,表明基于ROS杀伤肿瘤细胞的电毒性治疗激活了肿瘤细胞的保护性自噬,而加入氯喹(CQ)的处理组(Pt-Ir-CQ + E),自噬溶酶体的数量明显降低,并且指示自噬底物的p62蛋白明显增加,说明电毒性诱导保护性自噬,增强肿瘤细胞对ROS的抵抗力,而Pt-Ir-CQ NPs干扰溶酶体功能,从而阻断这种保护性自噬过程,增强肿瘤细胞对电毒性的敏感性。同时,在自噬抑制过程中,由于溶酶体功能受损,受损的蛋白和细胞器会积累,进一步放大了电毒性的氧化损伤的程度。体内实验后肿瘤组织的免疫组化染色结果也支持这一结论。
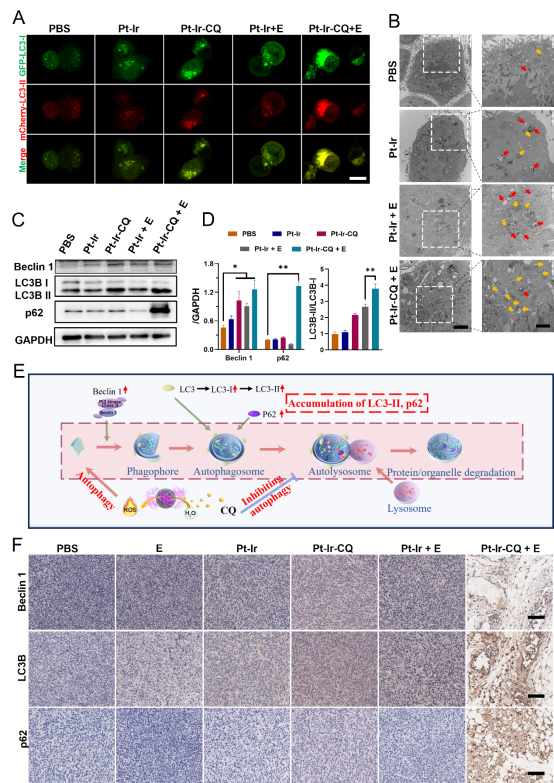
图2 体内和体外对自噬反应过程的评价
【双金属电敏剂激活免疫应答】
在Balb/c小鼠的皮下瘤模型中,Pt-Ir-CQ + E治疗组完全消除了肿瘤且几乎无复发,研究人员推断,电毒性治疗和自噬调节过程中激活了免疫反应从而实现对残留肿瘤组织的抑制。肿瘤组织的免疫荧光染色和流式分析实验结果表示,电毒性治疗可以诱发良好的ICD效应,促进树突状细胞的成熟和CD8+ T 细胞在瘤内的浸润。Pt-Ir-CQ + E治疗组协同电毒性和自噬抑制作用,促进M2-TAM极化为M1-TAM,表现出明显的 M1-TAM极化作用,重塑肿瘤免疫微环境并引发强大的抗肿瘤免疫反应。说明自噬抑制与电毒性治疗的相结合能够有效恢复肿瘤细胞对免疫治疗的敏感性,是一种可行有效的抗肿瘤措施。

图3 体内免疫反应的评价。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202402312


