上海科技大学朱幸俊教授团队《Small》:聚焦超声响应型机械发光纳米平台介导闭环控制的巨噬细胞工程用于精准癌症免疫治疗
时间:2024-08-12 16:00:32 热度:37.1℃ 作者:网络
巨噬细胞工程已成为癌症免疫治疗中的一种有前途的方法。然而,在巨噬细胞调控过程中,时空控制和实时反馈仍然存在挑战,这可能导致脱靶效应和疗效监测的延迟,从而增加免疫过度激活等严重副作用的风险。上海科技大学朱幸俊教授等人设计了一种聚焦超声响应型光学纳米平台(FUSION),以实现体内巨噬细胞工程的时空控制和状态报告。在聚焦超声(FUS)的刺激下,FUSION中封装的免疫激动剂释放以诱导肿瘤部位的巨噬细胞M1表型的选择性分化,同时产生FUSION的近红外机械发光以指示免疫激活的启动。由于促炎性M1巨噬细胞中羟基自由基的产生,FUSION的持久发光得到增强,这可以报告巨噬细胞调节的有效性。利用标记FUSION的巨噬细胞(FUSION-M)作为活免疫治疗剂可以进行肿瘤靶向和聚焦超声激活的癌症免疫治疗。通过将按需激活和反馈结合从而形成闭环,本研究中的纳米平台有望提高巨噬细胞工程和癌症免疫治疗的可控性以实现精准医疗。相关工作以“Closed-Loop Control of Macrophage Engineering Enabled by Focused-Ultrasound Responsive Mechanoluminescence Nanoplatform for Precise Cancer Immunotherapy”为题发表在Small。
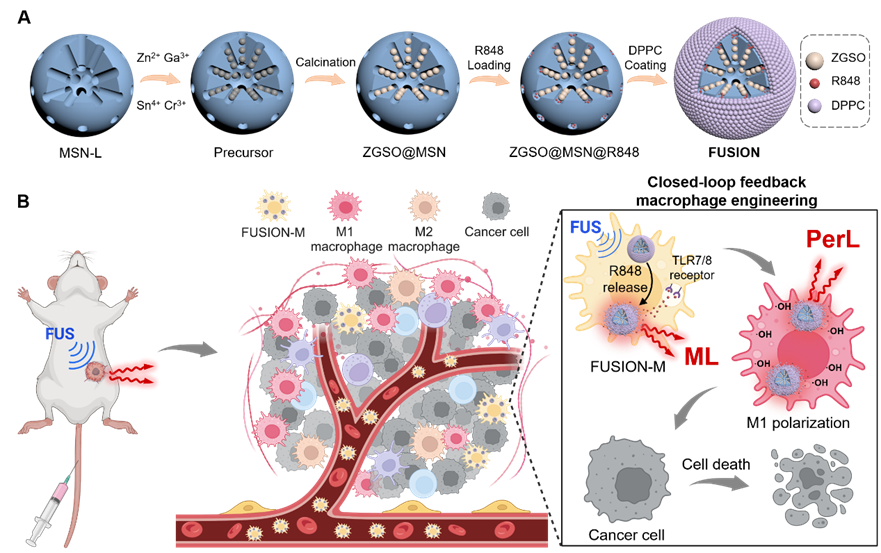
图1. 论文研究内容示意图
【FUSION的制备过程】
首先,在介孔二氧化硅(MSN)的孔结构中原位合成了具有近红外余辉发光(PerL)和机械发光(ML)的Zn1.2Ga1.6Sn0.2O4:0.5%Cr3+(ZGSO)纳米颗粒,为超声刺激和免疫激活提供光信号反馈。与MSN模板相比,ZGSO@MSN在煅烧后保持了球形结构,平均直径为93.1 nm。对其进行表面修饰后,Toll样受体7/8激动剂R848分子进一步负载在介孔纳米颗粒中,然后封装二棕榈酰磷脂酰胆碱(DPPC)层,形成聚焦超声反馈且负载免疫调节剂的光学纳米平台(FUSION)。FUSION在PBS中表现出单分散性,流体动力学直径为108.5 nm。
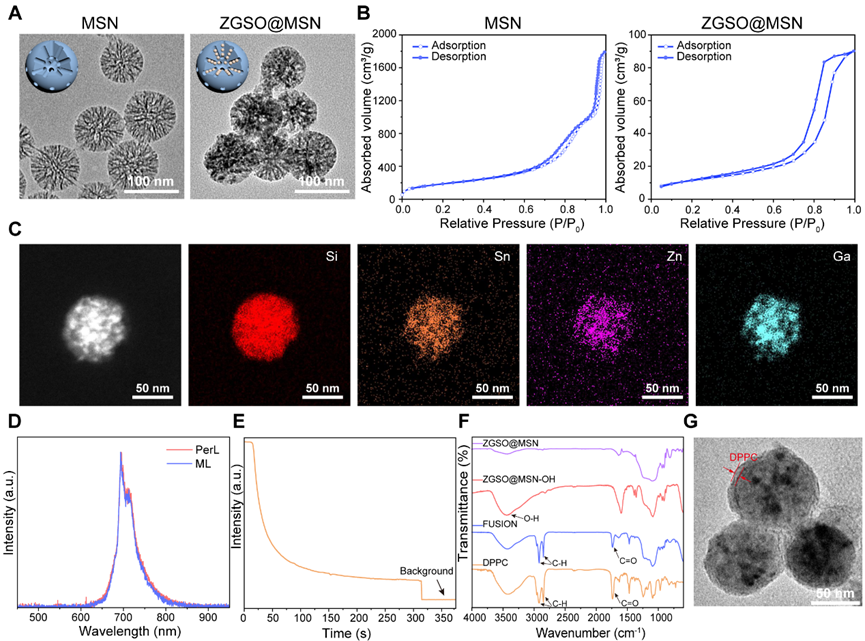
图2. FUSION纳米颗粒的表征
【FUSION聚焦超声反馈机械发光的表征】
为了验证使用FUSION作为体内超声响应发射器的可行性,将FUSION嵌入模拟生物组织的聚二甲基硅氧烷(PDMS)模具中。FUSION的机械发光可以通过FUS刺激产生,并且强度随着FUS功率的升高而相应增加。此外,在FUS激发下FUSION的机械发光具有可循环性,在光信号衰减后,使用635 nm LED可以对其进行充能从而实现FUSION的可重复使用。
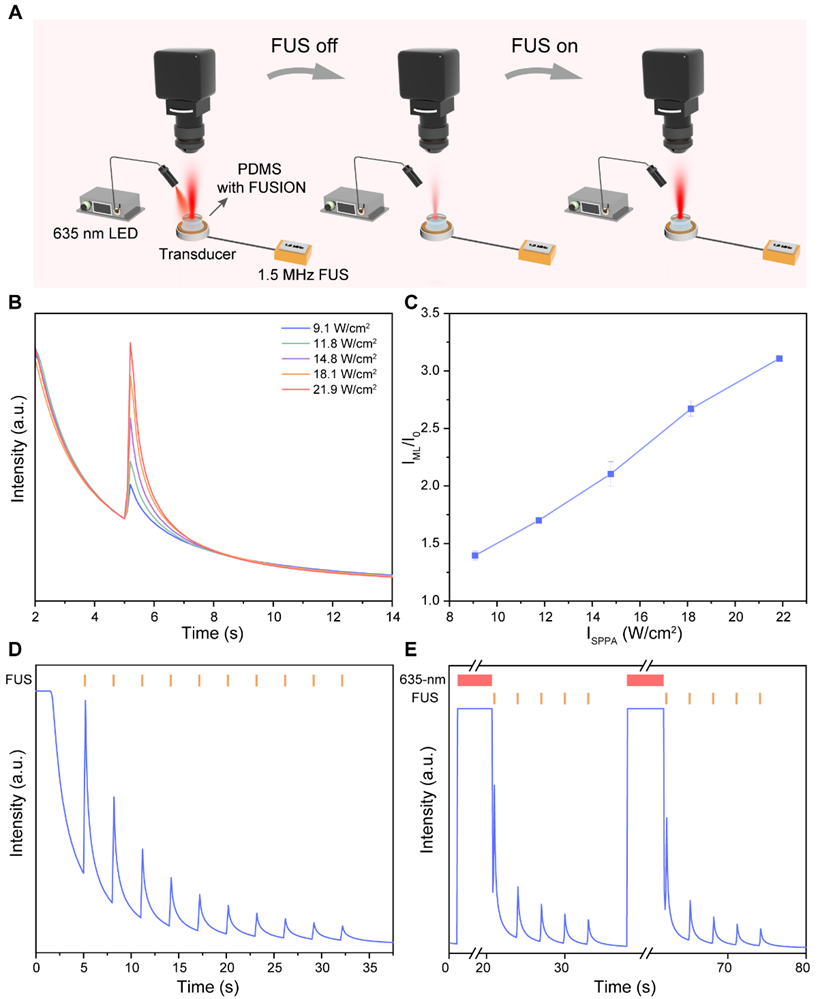
图3. FUSION的聚焦超声反馈机械发光表征
【FUS介导FUSION中免疫调节剂的可控释放】
随后,进一步验证聚焦超声介导FUSION中免疫调节剂R848的可控释放。R848的释放率具有FUS功率相关性。为了避免对巨噬细胞造成热损伤,选用33.9 W/cm2的FUS实现阶梯式的R848释放,施加三组FUS后R848释放率达到82.9%以上。此外,当FUS开启时,FUION的闪烁发光指示免疫调节剂释放的开始和免疫激活,为可控释放提供实时反馈。
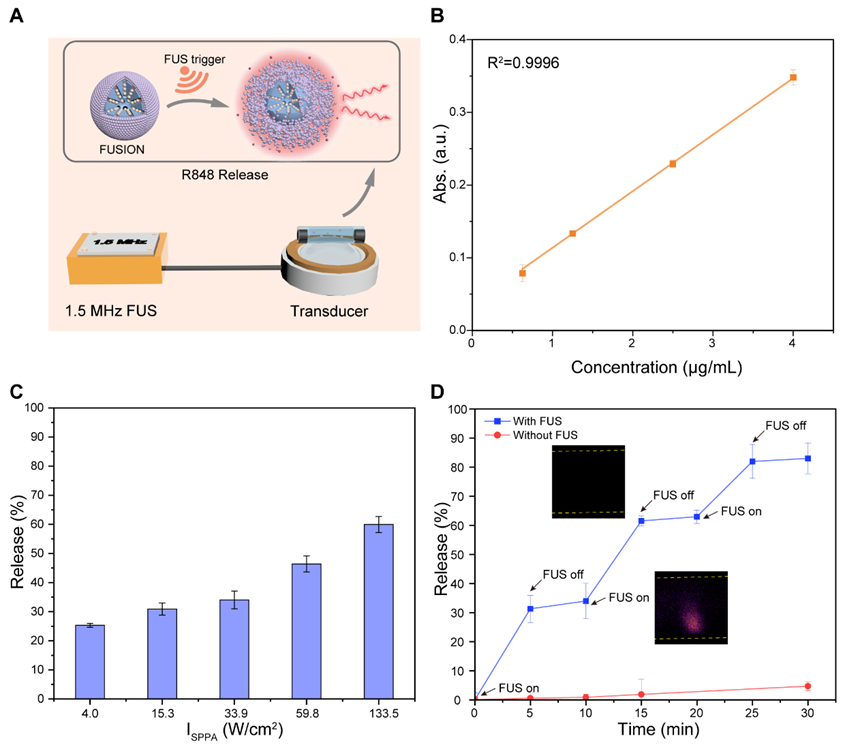
图4. FUS介导FUSION中免疫调节剂的可控释放
【FUSION介导的骨髓来源巨噬细胞的免疫调节】
肿瘤微环境中的趋化因子,如CSF-1、VEGF等,吸引单核细胞/巨噬细胞浸润肿瘤组织。因此,利用骨髓来源巨噬细胞(BMDM)的肿瘤趋向性作用,构建了标记有FUSION的骨髓来源巨噬细胞(FUSION-M)作为活免疫治疗材料用于肿瘤靶向。随后对FUSION-M进行FUS刺激,调节其极化以激活抗肿瘤作用并逆转免疫抑制微环境以达到治疗目的。通过BMDM与FUSION共培养以将FUSION标记上细胞,在应用FUS后,BMDM的细胞存活率仍可达到99.0%,表明FUSION和低功率FUS不会损伤BMDM。使用流式细胞术对FUSION-M的免疫激活进行表征,与对照组相比,经FUS刺激的FUSION-M(FUS+FUSION组)表达更高水平的CD86和更低水平的CD206。同时,ELISA显示,FUS+FUSION组中TNF-α的水平显著高于对照组,进一步证明低功率FUS触发免疫调节剂的释放可实现高效的免疫激活。
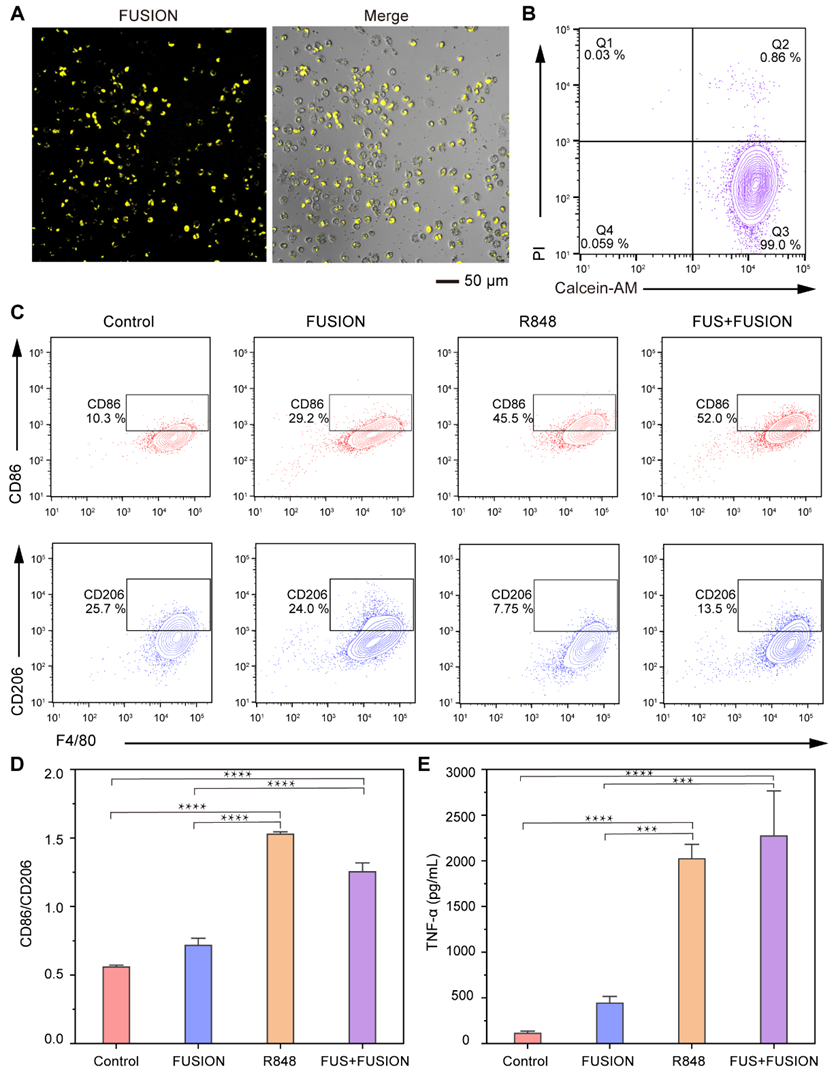
图5. FUSION介导的骨髓来源巨噬细胞的免疫调节
【FUSION-M的体内肿瘤靶向成像和免疫激活】
巨噬细胞迁移到肿瘤是由于肿瘤微环境中分泌的细胞因子,如CCL2、ICAM-1、整合素等,这些细胞因子促进巨噬细胞滚动、牢固附着于内皮细胞并迁移。利用巨噬细胞的肿瘤归巢性,将FUSION-M静脉注射到4T1荷瘤小鼠体内,实现肿瘤靶向和FUS触发的免疫治疗。FUSION-M注射后将FUS应用于肿瘤部位,在肿瘤部位可以观察到FUSION产生的机械发光,并且在重复的FUS脉冲应用下显示出多次响应,这用于指示R848释放和免疫激活的开始。为了使用FUSION指示体内促炎性M1巨噬细胞的生成,小鼠在注射FUSION-M 6 h后应用FUS,并在注射FUSION-M 24 h后进行成像。注射载R848的FUSION-M的小鼠肿瘤和肝脏中的PerL信号比值显著高于对照组,证实载免疫调节剂的FUSION-M在FUS刺激后能够诱导促炎表型巨噬细胞分化,从而在肿瘤微环境中产生更多的ROS。
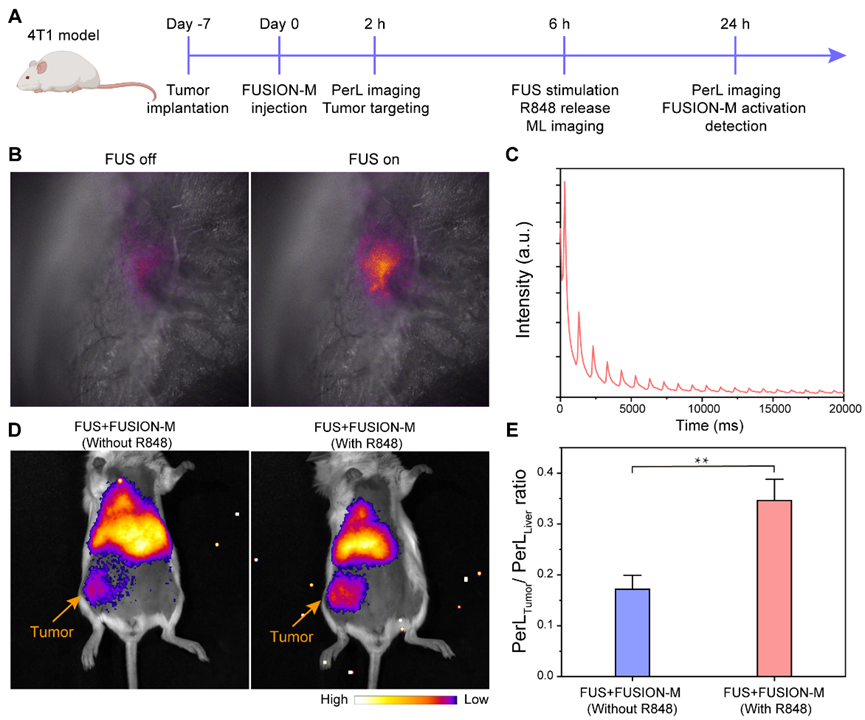
图6. FUSION-M的体内肿瘤靶向成像和免疫激活
【使用FUSION-M评估癌症免疫治疗效果】
在4T1荷瘤小鼠中评估FUSION-M的治疗效果。FUS+FUSION-M组表现出最高的肿瘤抑制作用,并且生存期得到有效延长。免疫荧光结果表明,与对照组相比,FUS+FUSION-M组的促炎M1巨噬细胞的丰度增加。此外,瘤内Elisa结果显示,FUS+FUSION-M组中TNF-α的含量显著增加,而IL-10的含量显著减少,证明了FUS刺激可以在体内实现FUSION-M的M1表型分化,从而激活免疫功能,形成促炎性肿瘤微环境,进而消除肿瘤。此外,对小鼠主要脏器IL-6的分泌水平,血液学标志物以及血清生化进行测定,分别评估了FUSION-M潜在的局部组织炎症反应,系统性炎症反应,以及对造血、肝肾的影响,相关结果进一步证实了该策略在体内使用的生物安全性。
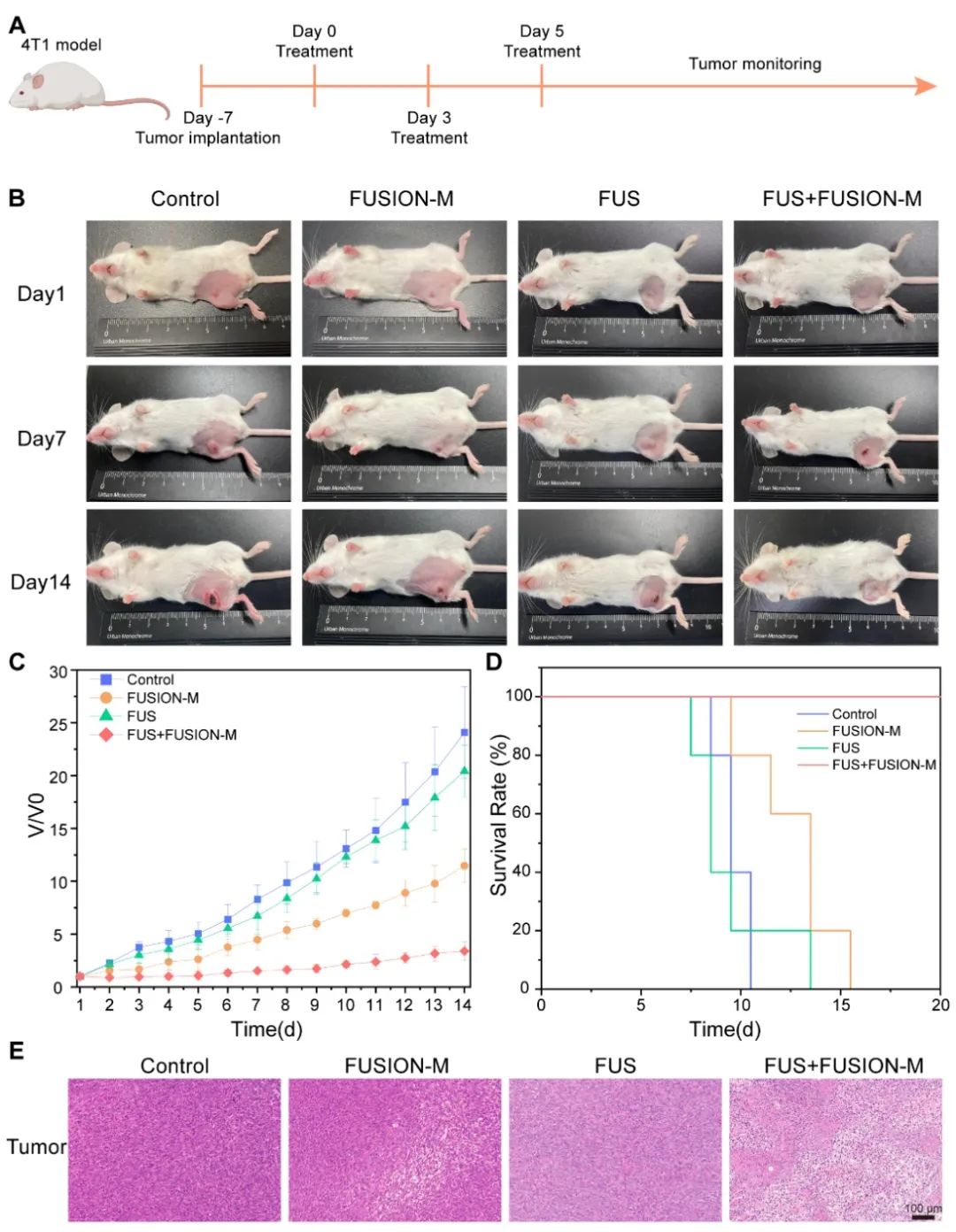
图7. 使用FUSION-M和FUS进行体内癌症治疗
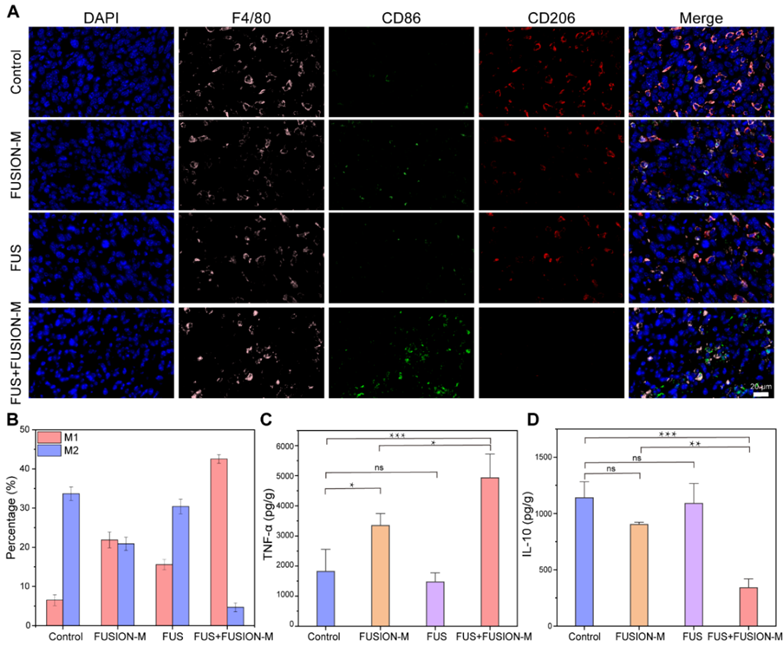
图8. 使用FUSION-M和FUS进行体内癌症治疗
【总结】
本研究开发了一种负载免疫调节剂的聚焦超声反馈型光学纳米平台(FUSION),实现了闭环和时空可控的巨噬细胞工程,用于癌症免疫治疗。FUSION标记骨髓来源巨噬细胞形成活免疫治疗剂(FUSION-M),利用巨噬细胞的肿瘤趋向性进行靶向,通过聚焦超声(FUS)激活促炎性巨噬细胞极化实现癌症免疫治疗。FUSION的近红外机械发光可实时反馈FUS刺激,以微创方式监测体内免疫激活的启动。FUSION近红外余辉发光的增强可以报告促炎性肿瘤微环境的形成。结果表明,FUS可以在体外有效调控工程化巨噬细胞的表型,并在肿瘤小鼠中表现出显著的肿瘤抑制作用。这项工作提供了一种基于超声响应型纳米材料的工程免疫细胞的癌症免疫治疗策略,改善时空控制并提高治疗准确性,这对于推进癌症免疫治疗具有巨大潜力。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202401398


