浙大林能明/顾臻/董晓武AM:可注射可喷涂荧光纳米探针,实现人结直肠肿瘤快速实时检测
时间:2024-08-01 17:00:25 热度:37.1℃ 作者:网络
微创手术的发展极大地推进了精准肿瘤手术,但有时在手术过程中,特别是在腹部肿瘤切除时,受限于手术视野的可视化问题。通过静脉注射肿瘤选择性荧光探针可以实现肿瘤的三维检测,然而,大多数探针无法通过术中方便的现场喷涂方式即时区分肿瘤。在手术过程中,迫切需要一种能够方便地实现这一功能的探针。在本研究中,浙江大学林能明、顾臻、董晓武团队设计了一种可注射和喷涂的荧光纳米探针,称为Poly-g-BAT,以实现对新鲜解剖的人类结直肠肿瘤和动物模型的快速肿瘤成像。从机制上讲,γ-谷氨酰基团的引入促进了Poly-g-BAT的快速内化,这些内化的纳米探针随后可以被细胞内的NAD(P)H:醌氧化还原酶-1激活,以释放近红外荧光团。结果,Poly-g-BAT能够实现高达12.3的优越肿瘤-正常比率(TNR),并能够在异种移植肿瘤模型、Apcmin/+小鼠模型和新鲜人类肿瘤组织中快速可视化(现场喷涂后3分钟内)肿瘤边界。此外,Poly-g-BAT还能够通过静脉注射识别最小的前恶性病变。该研究以题为“Injectable and Sprayable Fluorescent Nanoprobe for Rapid Real-Time Detection of Human Colorectal Tumors”的论文发表在《Advanced Materials》上。

图1展示了可注射和可喷涂的纳米探针Poly-g-BAT的设计、特性及其对γ-谷氨酰转肽酶(GGT)和NAD(P)H醌氧化还原酶1(NQO1)的响应性。Poly-g-BAT通过GGT催化的水解作用迅速转变为带正电荷的状态,从而促进了其在肿瘤细胞中的快速摄取。随后,NQO1介导的醌还原触发了电子转移,迅速释放荧光团。实验结果表明,Poly-g-BAT在与NQO1和NADH共处理后,荧光发射随时间逐渐增强,并在20分钟后达到最大波长715纳米的荧光强度平台,证实了其在肿瘤细胞中的高灵敏度和快速可视化能力。此外,Poly-g-BAT对NQO1具有特异性响应,即使在存在多种干扰物质的情况下也能稳定地发出荧光,显示出其在肿瘤特异性成像中的潜力。
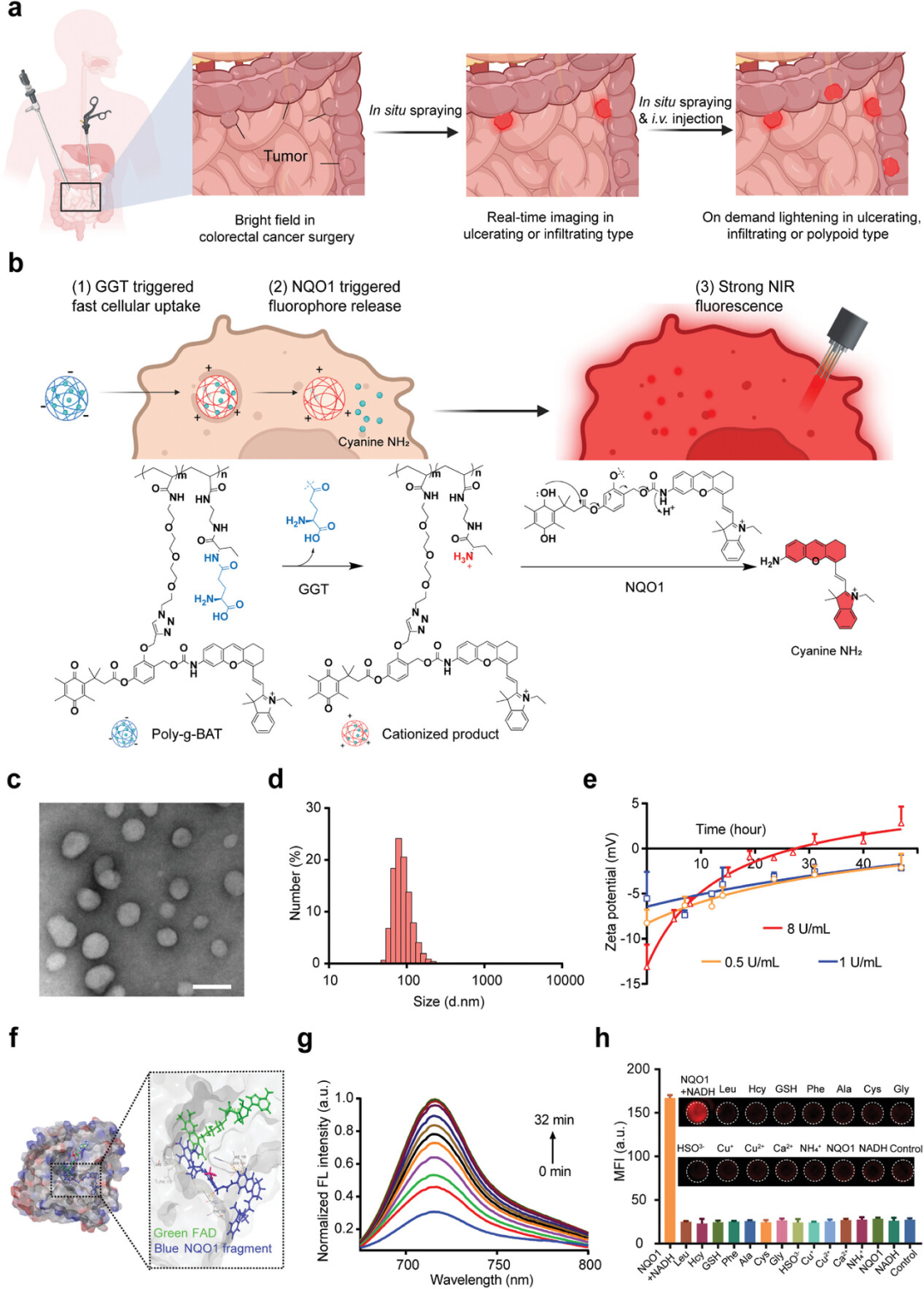
图1. Poly-g-BAT的示意图、特性及其响应性
【γ-谷氨酰水解介导的快速细胞摄取】
图2展示了通过γ-谷氨酰水解介导的Poly-g-Cy5.5的快速细胞摄取过程,并与负对照Poly-Cy5.5进行了比较。实验结果表明,经Poly-g-Cy5.5处理的HCT116细胞在2小时后显示出显著更高的荧光强度,与Poly-Cy5.5处理的细胞相比,流式细胞仪检测显示更多的细胞被荧光标记。这些结果证实了γ-谷氨酰水解在肿瘤细胞快速摄取纳米探针中的必要性。此外,使用GGT抑制剂GGsTOP预处理HCT116细胞后,Poly-g-BAT的荧光强度下降了45%,进一步证实了GGT在Poly-g-BAT快速细胞摄取中的关键作用。体内荧光成像也证实了Poly-g-BAT对GGT的响应性,表明GGT在Poly-g-BAT的肿瘤特异性成像中起着至关重要的作用。
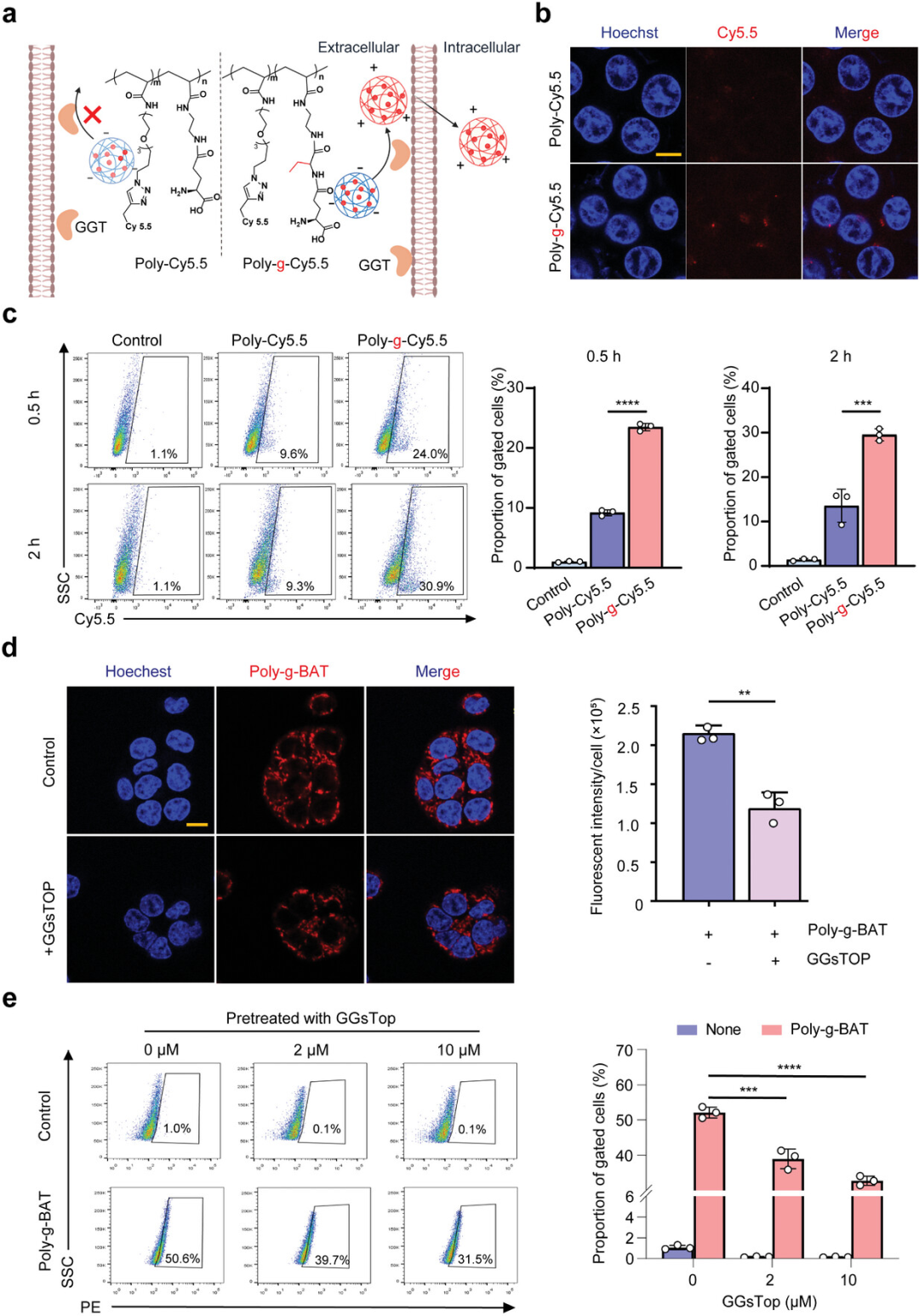
图2. γ-谷氨酰水解介导的快速细胞摄取
【小鼠模型中原位喷涂后的荧光成像】
图3展示了Poly-g-BAT在肿瘤特异性成像中的效果,以及通过原位喷涂实现的图像引导下的肿瘤切除。实验中,Poly-g-BAT、BAT或ICG被均匀喷涂在暴露的肿瘤腔上,以描绘恶性病变。结果显示,Poly-g-BAT在喷涂3分钟后能够准确点亮肿瘤,并且未在邻近正常组织中观察到可检测的荧光。通过定量分析和H&E染色,证实了肿瘤的完全切除。与此相比,ICG或BAT喷涂后荧光扩散至整个腔室。此外,Poly-g-BAT在ApcMin/+小鼠模型中通过喷涂能够识别肠道腺瘤,这些腺瘤经过H&E染色后得到了病理学确认。这些数据揭示了Poly-g-BAT作为一种有效的荧光探针用于结直肠癌病变的潜力。最后,Poly-g-BAT实现了高达12.3的肿瘤-正常比率(TNR),并且在不到30分钟的时间内就达到了高TNR值,显示了其在荧光成像中的高效率。
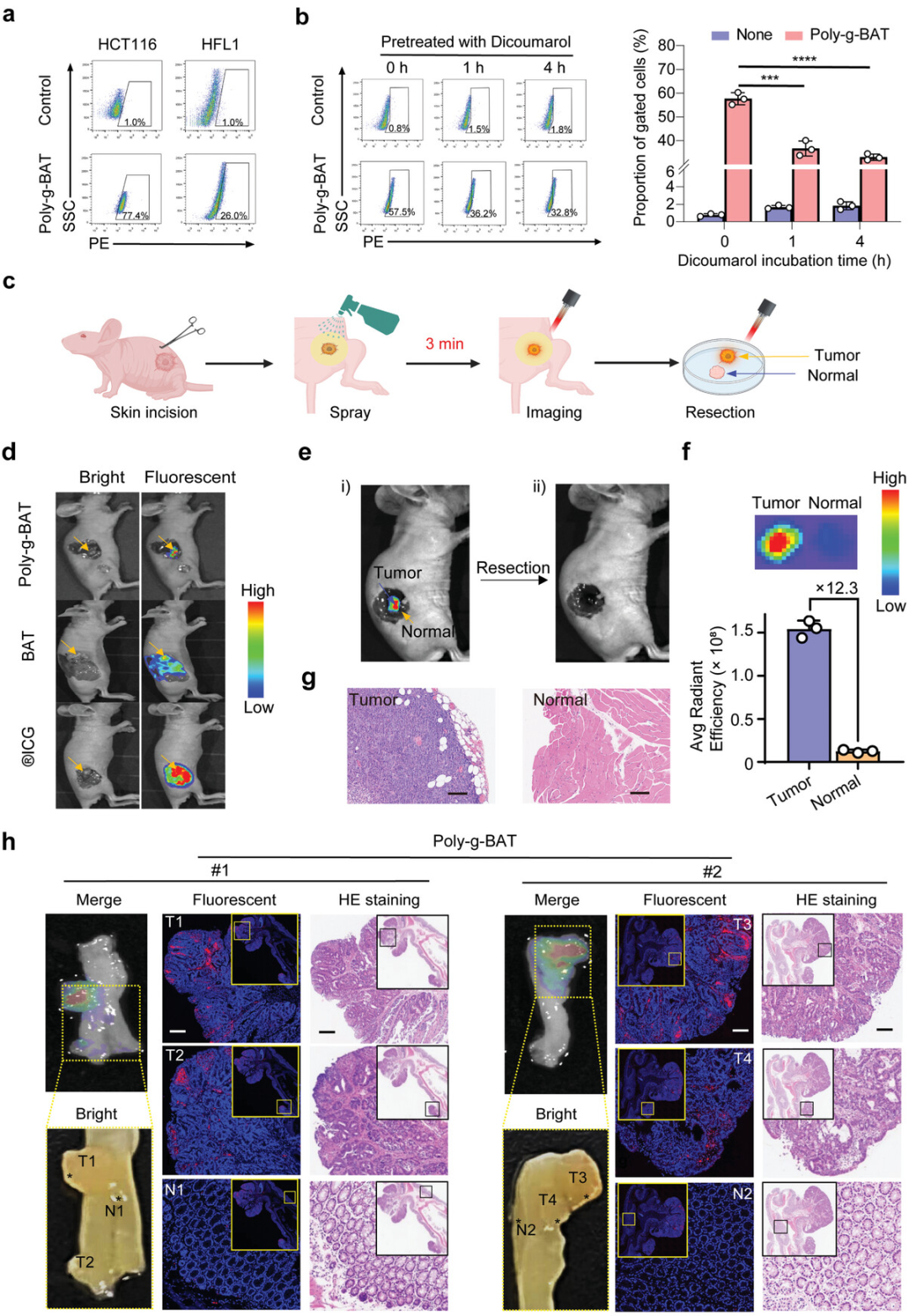
图3. 小鼠模型中原位喷涂后的荧光成像
【原位喷涂Poly-g-BAT引导的肿瘤切除】
图4展示了原位喷涂的Poly-g-BAT在图像引导下对肿瘤切除的指导作用。实验中,Poly-g-BAT被喷涂在HCT116异种移植瘤小鼠模型的暴露肿瘤及其邻近组织上,通过4K内窥镜荧光系统模拟实际手术中的肿瘤切除过程。结果表明,Poly-g-BAT在喷涂后3分钟内就能被荧光腹腔镜系统检测到,显示出对肿瘤组织的高亲和力和快速的荧光响应,而对邻近的正常组织没有影响。相比之下,ICG在同一条件下未能区分肿瘤和健康组织。此外,通过荧光腹腔镜系统观察到,Poly-g-BAT的荧光信号在肿瘤切除后仍然保持,有助于确保肿瘤组织的完全移除。这些发现证实了Poly-g-BAT在快速、高对比度的肿瘤成像中具有潜在的应用价值,能够用于图像引导下的肿瘤精确切除。
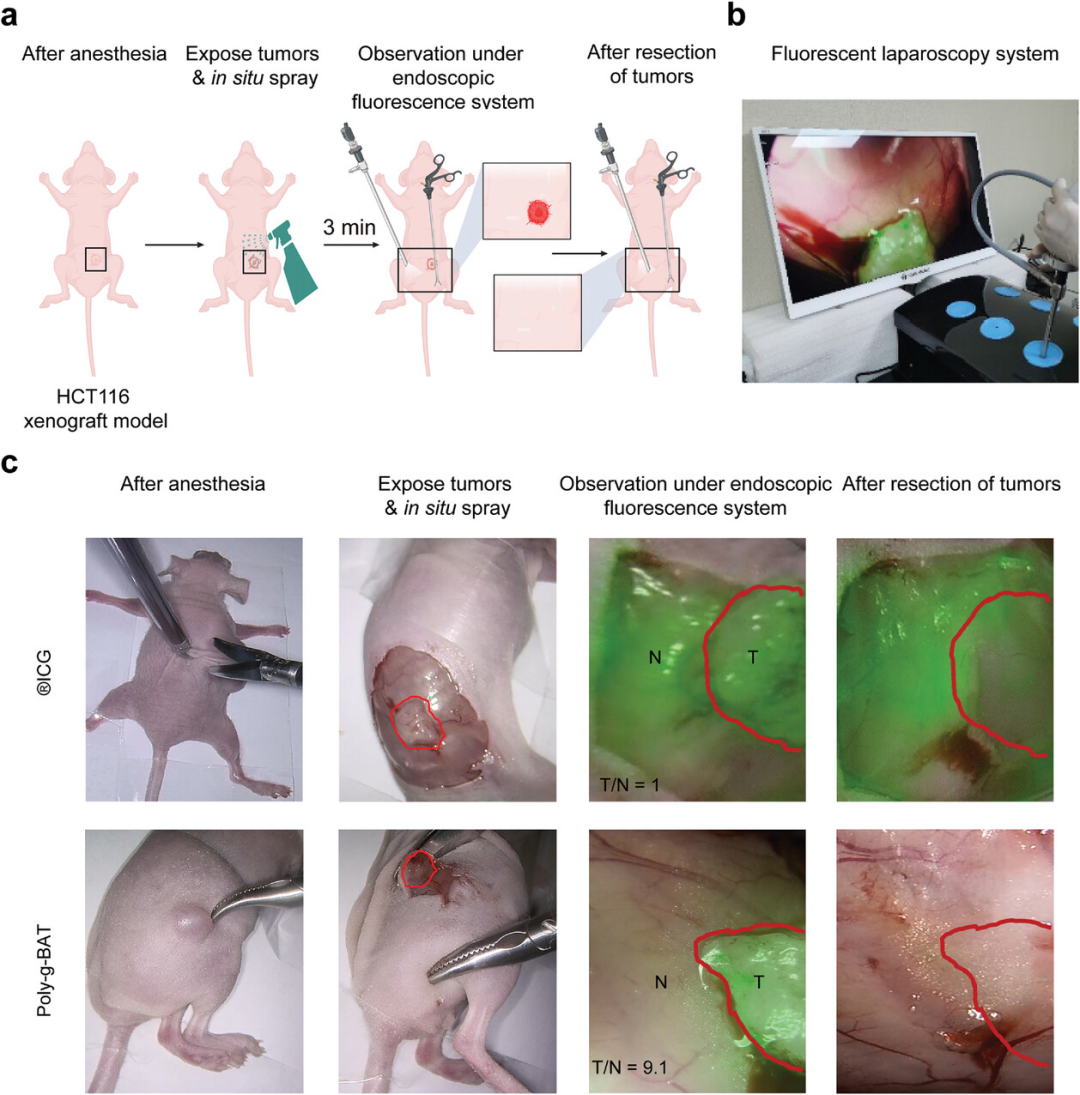
图4. 原位喷涂Poly-g-BAT引导的肿瘤切除
【ApcMin/+小鼠模型中肠道病变的检测及生物相容性评估】
图5展示了在ApcMin/+小鼠模型中通过尾静脉注射Poly-g-BAT来识别微小的结直肠病变的能力,并评估了其生物相容性。实验中,Poly-g-BAT注射后,小鼠的结直肠组织在近红外荧光成像下能够检测到恶性病变,而生理盐水注射的背景荧光信号可以忽略不计。病理分析通过H&E染色确认了肿瘤细胞的存在。与Poly-g-BAT相比,结构类似物Poly-g(o)-BAT由于电子转移特性较弱,显示出较低的肿瘤识别能力。此外,实验还表明,Poly-g-BAT的荧光成像能够揭示微小的癌前病变,这些病变在H&E染色前无法被确定为癌组织。连续组织切片的H&E染色和荧光成像进一步验证了小于1毫米直径的癌性病变的病理特征。这些结果突出了Poly-g-BAT在检测微小结直肠癌病变中的潜在应用,并且通过连续4天的注射后对主要器官的毒性评估显示,Poly-g-BAT在小鼠中具有良好的生物相容性。
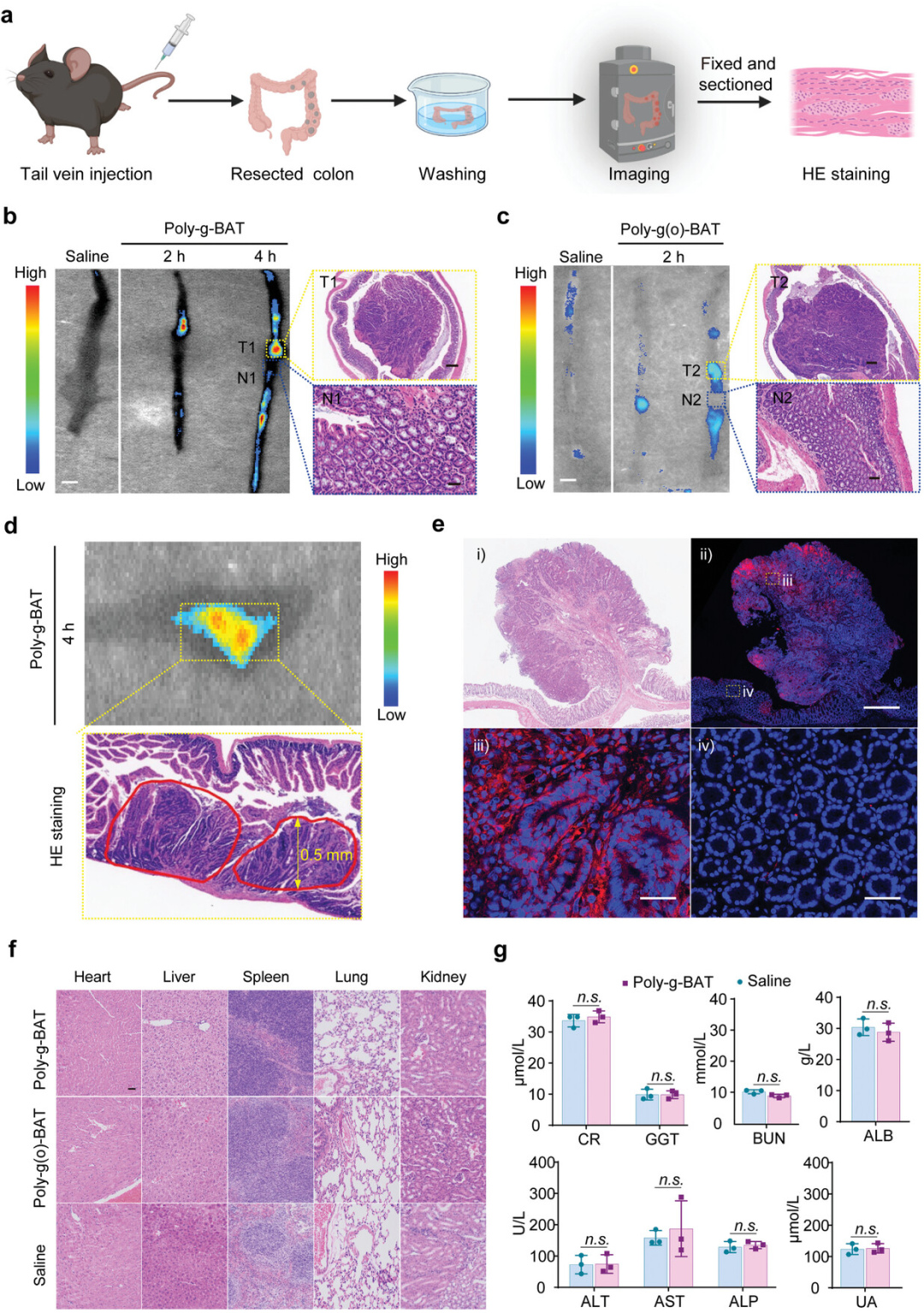
图5. ApcMin/+小鼠模型中肠道病变的检测及生物相容性评估
【使用Poly-g-BAT、BAT和ICG成像的人体结肠组织】
图6展示了Poly-g-BAT、BAT和ICG在新鲜解剖的人体结肠组织成像中的应用,并比较了它们在肿瘤组织和正常组织中的荧光效率和肿瘤-正常比率(TNR)。实验过程中,这些探针与新鲜切除的组织共孵育后,通过荧光成像系统捕获了时间依赖性的荧光图像。结果显示,与单一响应探针BAT相比,Poly-g-BAT在肿瘤选择性成像方面表现出更高的TNR值,且在不到30分钟的时间内就达到了高TNR值,表明了其在荧光成像中的高效率。特别是在与ICG相比时,Poly-g-BAT在正常和肿瘤组织中均显示出较低的荧光信号,而Poly-g-BAT在肿瘤组织中的荧光强度随时间增加,而正常组织中的荧光强度则保持较低水平。
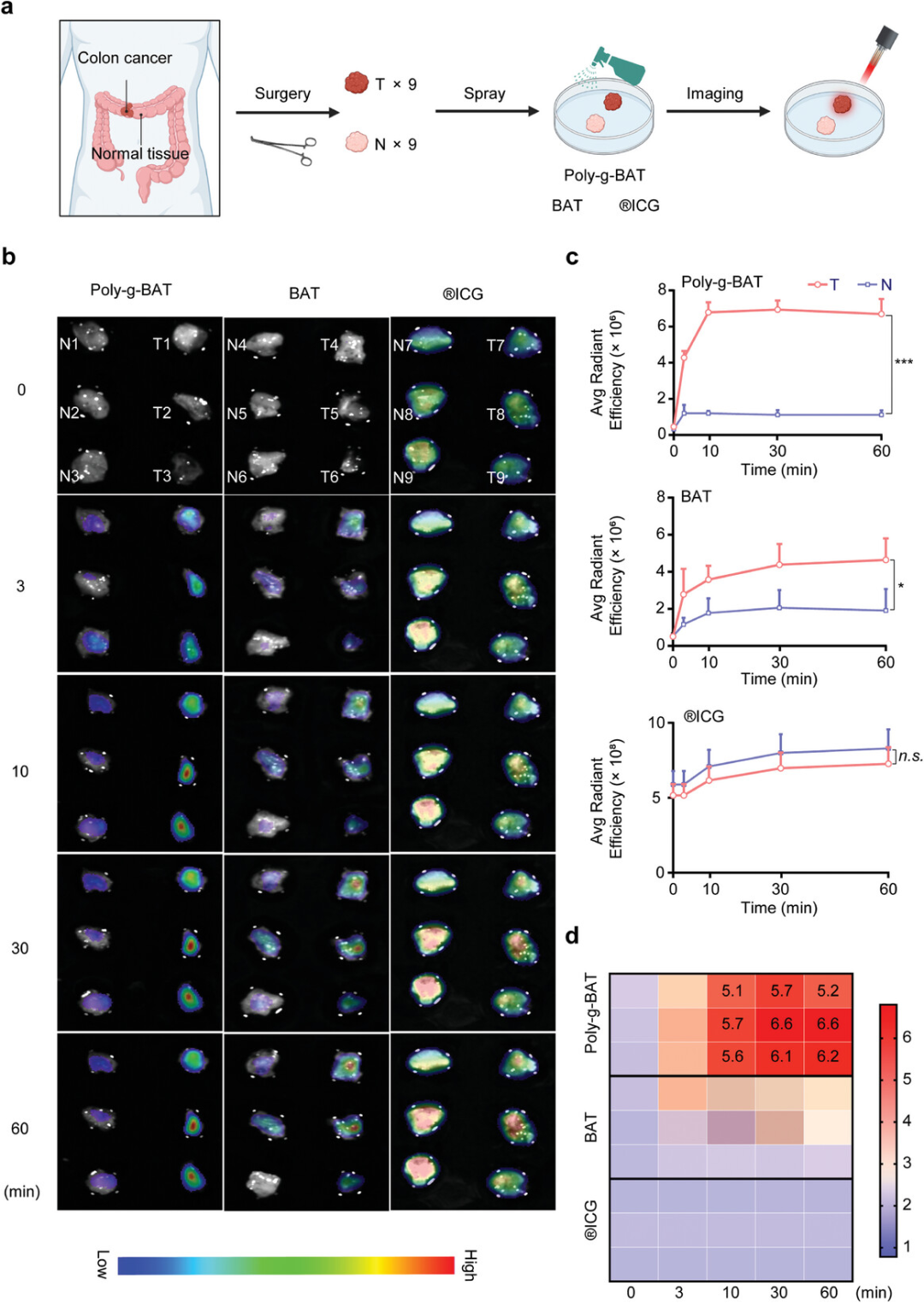
图6. 使用Poly-g-BAT、BAT和ICG成像的人体结肠组织
【小结】
该研究描述了一种可注射和可喷涂的荧光纳米探针Poly-g-BAT,它能够快速被肿瘤细胞内化,实现新鲜解剖的人类结直肠肿瘤和动物模型中的肿瘤特异性成像。Poly-g-BAT通过原位喷涂达到了高达12.3的优越肿瘤-正常比率(TNR),并在3分钟内快速可视化异种移植肿瘤模型、ApcMin/+小鼠模型以及荧光腹腔镜下的肿瘤边界。由于其快速响应性和高对比度的肿瘤成像能力,Poly-g-BAT能够识别直径小于1毫米的微小结直肠腺瘤和癌。该策略为开发用于快速和特异性肿瘤成像的可注射和可喷涂纳米探针提供了一个有希望的平台,并证实了这些纳米探针在图像引导下的肿瘤切除中具有潜在应用。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202405275


