PTPRZ1-MET融合胶质母细胞瘤获益特泊替尼辅助治疗,完全缓解长达35个月
时间:2024-07-15 18:00:33 热度:37.1℃ 作者:网络
尽管目前有治疗方法,但胶质母细胞瘤(GBM)患者的预后仍然很差。尽管研究人员对GBM的靶向治疗进行了深入研究,但在临床试验中并未取得成功。GBM靶向治疗失败的原因是多方面的,包括试验中缺少对患者的选择、未能识别驱动突变以及研究药物的血脑屏障渗透性差。本文描述了一例新诊断的GBM患者,该患者存在软脑膜播散和PTPRZ1-MET融合,接受中枢神经系统渗透性MET抑制剂特泊替尼治疗后,获得了持久的完全缓解。这例GBM患者靶向治疗成功,表明早期分子检测、识别驱动分子变异以及使用中枢神经系统渗透性小分子抑制剂治疗有可能改变部分GBM患者的预后。
背 景
间充质上皮转化(MET)致癌基因编码肝细胞生长因子,这是一种受体酪氨酸激酶,可调节细胞发育和生长。MET融合、拷贝数扩增和点突变是许多实体瘤的驱动因素。胶质母细胞瘤(GBM)MET变异的发生率在 2%-5%,MET激活与胶质瘤预后较差有关,具体表现为无进展生存期较短、总生存期较短和WHO分级较高。
在许多癌症中,包括胶质母细胞瘤,融合基因可导致致癌基因的扩增。蛋白酪氨酸磷酸酶受体zeta 1 型(PTPRZ1)和MET的融合于 2014 年首次被描述,是由PTPRZ内含子与MET原癌基因之间的易位引起的,PTPRZ通常在中枢神经系统组织中高表达。PTPRZ1-MET融合导致MET激酶的配体非依赖性激活,这是由卷曲螺旋结构蛋白修饰实现的。PTPRZ1- MET融合诱导MET癌蛋白的表达和磷酸化增加,从而导致MET-PIK3CA-AKT1调节剂STAT3 通路的表达增加。临床前证据表明,异常的MET融合是MET激活的驱动因素,导致肿瘤细胞具有不依赖肝细胞生长因子的自我激活。一项研究报告称,15% 的源自低级别肿瘤的高级别星形细胞瘤存在PTPRZ1-MET融合,并且生存率明显较差(融合患者的中位OS为 127 天,而非融合患者的中位OS为 248 天)。临床前证据还表明MET融合的肿瘤对MET酪氨酸激酶抑制剂(TKI)敏感,这表明PTPRZ1-MET融合是治疗具有这种改变的神经胶质瘤的潜在靶点
第一代MET抑制剂卡博替尼对复发性GBM的疗效有限。这可能是由于血脑屏障穿透性差、激酶缺乏选择性,以及在治疗开始前没有对携带MET变异的患者进行选择。最近,Ib期GEINO 1402试验除了研究标准放疗和替莫唑胺外,还研究了克唑替尼,随后进行克唑替尼维持治疗,结果表明该方案安全耐受,值得进一步研究。盐酸特泊替尼是一种口服MET酪氨酸激酶抑制剂,可选择性与MET结合并抑制其磷酸化。2021 年,FDA加速批准特泊替尼用于治疗携带MET 14 号外显子跳变的转移性非小细胞肺癌,理由是在非随机、开放标签研究中的客观缓解率有所提高。目前有几项研究正在进行中,以确定特泊替尼对晚期实体瘤(包括神经胶质瘤)的疗效。然而,其在胶质母细胞瘤中的应用尚未确认。
本文介绍了一个病例,其中特泊替尼辅助单药治疗对播散性GBM(IDH野生型,PTPRZ1-MET融合)有效,产生完全缓解并持续 35 个月。特泊替尼单药治疗的成功使其有望成为MET变异GBM患者传统烷化剂疗法的宝贵替代疗法。
病 例
患者男,30 岁,因持续 3 年轻度头晕和间歇性灼烧感,近期新发头痛,于 2020 年 4 月就诊。颅部MRI显示右侧脑室肿块,伴有实质侵犯和小脑增强结节(图1a)。2020 年 5 月,患者接受了次全切除术,术后影像学显示右侧脑室中后体残留有结节性强化,小脑内结节性强化灶未改变(图1b)。病理检查显示GBM,WHO 4 级,IDH野生型,MGMT未甲基化。进行了下一代测序检测,结果显示PTPRZ1-MET融合和7q31.2处的MET扩增呈阳性。
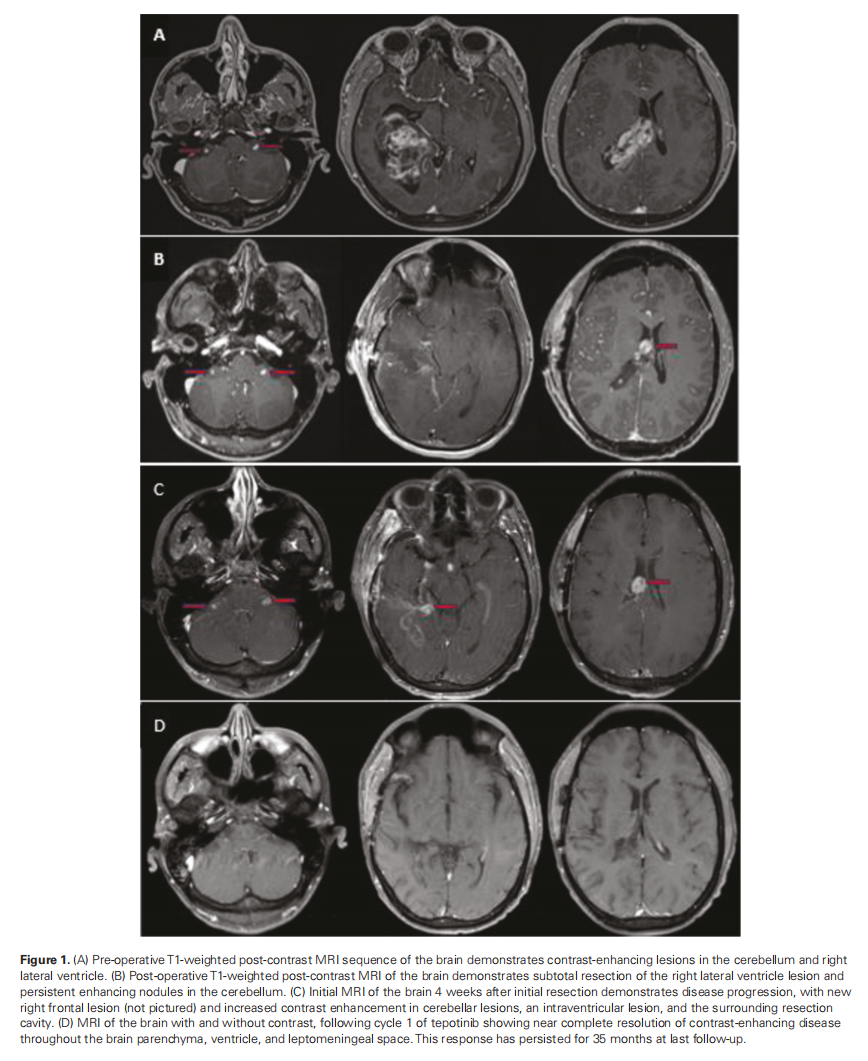
▲图1 术前(A)、术后(B)的MRI影像,切除4周后复发(C),以及 1 个周期特泊替尼治疗后增强病变完全消退(D)
由于肿瘤位于脑室内,因此进行了脊柱MRI检查,结果显示颈胸段脊髓和马尾神经多灶性增强,可能存在软脑膜扩散(图2a)。初步检查发现患者有左侧同向性偏盲和左侧感觉丧失;卡氏评分为 90 分。4 周后重复进行MRI检查以制定放疗计划,结果显示肿瘤迅速进展,脑室和脑室外脑脊液腔内出现多个新的增强结节(图 1c)。患者接受 3600 cGy质子颅脑脊髓照射,随后接受了 2400 cGy IMRT。由于放疗区域过大且担心神经毒性,患者未同时接受替莫唑胺(TMZ)治疗。在同步放化疗期间,患者出现了颅脑脊髓照射引起的 2 级中性粒细胞减少和 3 级淋巴细胞减少,但无需干预。颅脑脊髓照射后影像学检查显示病情持续进展;因此,在同步放化疗后 4 周开始TMZ辅助治疗。临床团队将特泊替尼添加到TMZ辅助治疗中,将其作为同情用药。然而,在完成 2 个周期的TMZ辅助治疗后,患者出现了长时间的 2 级中性粒细胞减少症,无法开始第 3 个周期的TMZ辅助治疗。随后开始每天接受 1000 mg特泊替尼单药治疗。接受 1 周期特泊替尼单药治疗后,脑部和脊柱MRI显示增强病变完全消退(图1d和2b)。接受 2 周期 1000 mg特泊替尼治疗后,由于出现 1 级肌酐升高和 1 级腹部不适,剂量减至每日 500 mg。接受 9 周期治疗后,患者从同情用药转为市售药物,剂量相当于 450 mg 特泊替尼。开始接受特泊替尼治疗 35 个月后,患者出现进行性头痛,小脑疾病进展。
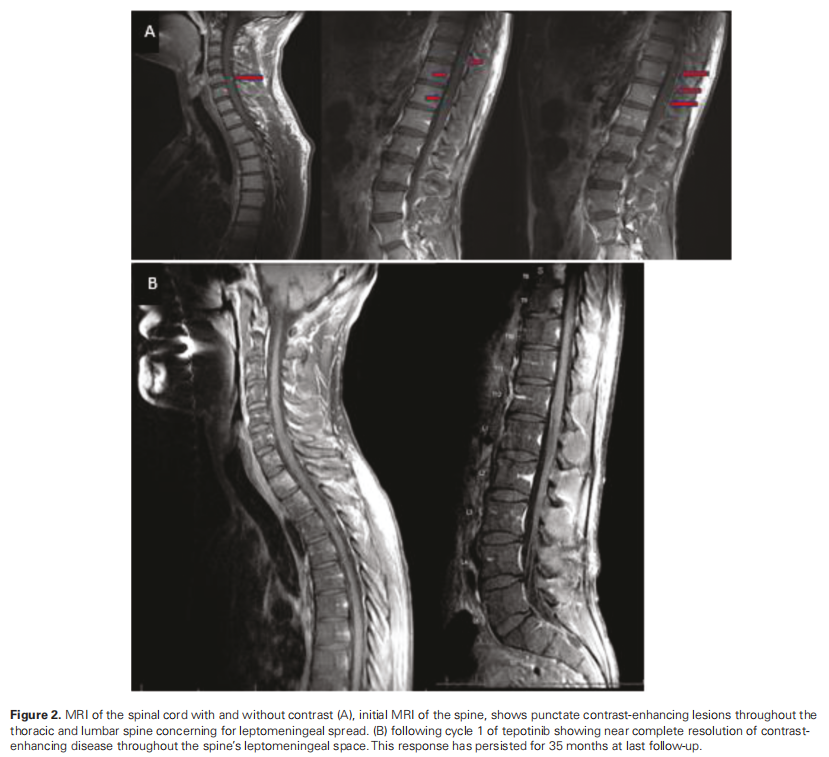
▲图2 脊髓MRI影像
讨 论
对未经分子选择的GBM患者进行的靶向治疗试验大多未取得成功,可能是因为缺乏患者选择、未能识别驱动突变,以及研究药物的血脑屏障渗透性差。现在患者的选择比前几年更加细致,因为癌症中心对大多数胶质母细胞瘤患者常规进行下一代测序。分子检测panel的扩展及其在胶质瘤中的广泛使用,导致人们对在GBM患者群体中进行靶向治疗研究重新产生了兴趣。PTPRZ1-MET融合和MET扩增是本文患者的下一代测序panel中仅有的分子变异;因此研究人员怀疑这是肿瘤的驱动改变。PTPRZ1-MET融合被描述为胶质瘤进展的驱动因素和MET抑制剂敏感性的标志物。除了患者选择和针对相关驱动突变之外,治疗药物穿透血脑屏障的能力对于其在中枢神经系统临床试验中的成功至关重要。以特泊替尼为例,在患有脑转移的非小细胞肺癌患者中观察到了显著的颅内反应;这一令人鼓舞的结果鼓励研究人员在患有胶质母细胞瘤的患者身上使用特泊替尼。
本文病例证明了使用特泊替尼靶向携带MET变异GBM的前景。研究人员观察到患者在控制GBM生长方面有即时和持久的反应。在特定患者群体中,在辅助治疗环境中(放疗后)进行早期靶向治疗,代替或补充TMZ,可以成为GBM的有效治疗策略。由于携带MET变异的GBM患者预后往往较差,因此必须找到标准治疗的替代方案。未来的临床试验将进一步阐明特泊替尼在经分子检测选择的脑肿瘤患者中的作用。
参考文献:
Lily C Pham, Lauryn Weller, Claudia N Gann, Karl Maria Schumacher, Soetkin Vlassak, Todd Swanson, Kaitlin Highsmith, Barbara J O’Brien, Sebnem Nash, Ashley Aaroe, John F de Groot, Nazanin K Majd, Prolonged complete response to adjuvant tepotinib in a patient with newly diagnosed disseminated glioblastoma harboring mesenchymal-epithelial transition fusion, The Oncologist, 2024;, oyae100, https://doi.org/10.1093/oncolo/oyae100



