【论著】| 乳腺癌原代细胞系为药物筛选和基础研究提供癌症新模型
时间:2024-07-14 18:00:33 热度:37.1℃ 作者:网络
[摘要] 背景和目的:2016年美国国家癌症研究所(National Cancer Institute,NCI)宣布不再使用NCI-60细胞系进行药物筛选,提示传统的肿瘤细胞系失去作为药物研发和基础研究工具的价值。NCI-60细胞“退休”原因是基于癌症细胞系和动物的实验结果没有在临床试验中获得对应的预期,导致绝大部分潜在药物临床试验失败。癌症细胞系失去价值归因于肿瘤细胞经过长期培养后,其增殖和转移等主要生物学行为和与之有关的关键蛋白质系统发生了根本改变,已不能代表患者的真实癌症特征。现阶段需要创立一种来源于患者新鲜癌症组织和具有清晰临床背景的新癌症模型。本研究旨在为药物研发和基础研究建立经济的患者来源的可以无限传代的乳腺癌原代细胞系。方法:乳腺癌组织在贵州医科大学附属医院乳腺外科收集。肿瘤组织样本收集得到贵州医科大学附属医院伦理委员会批准(伦理编号:2022伦理第313号),收集和使用肿瘤组织均遵守赫尔辛基宣言,患者的乳腺癌组织消化分离后在BCMI培养基中培养,待乳腺癌细胞增殖到一定数量时更换成DMEM培养基。乳腺癌细胞经短串联重复序列(short tandem repeat,STR)检测确定细胞特异性遗传学标志和来源。克隆形成实验和动物实验分析乳腺癌原代细胞系形成肿瘤的能力。结果:成功建立了6种乳腺癌原代细胞系。他们具有清晰的临床病理学特征,包括病理学标志性分子检测、临床诊断、治疗方案和结果以及确定的预后结果。STR检测确定了6种乳腺癌原代细胞系特异性遗传标志和确定了该细胞系的来源。克隆形成实验和动物移植实验说明乳腺癌原代细胞系增殖能力显著大于传统乳腺癌细胞系,二者在形成肿瘤能力方面存在明显的差异。结论:构建的6种乳腺癌原代细胞系为乳腺癌药物研发和基础研究提供了新的癌症模型。
[关键词] 乳腺癌原代细胞系; 药物研发; 基础研究;新癌症模型
[Abstract] Background and purpose: In 2016 the National Cancer Institute (NCI) decided stopping to use NCI-60 cell lines for drug screening, suggesting that tumor cell lines were losing their value as a tool for drug discovery and basic research. The reason for NCI-60 cells 'retirement' was that the preclinical studies based on traditional cellular and animal models did not obtain the corresponding expected efficacy in clinical trials. Since the major cancer behaviors, such as proliferation and metastasis, are fundamentally altered with long-term culture, the tumor cell lines are not representative of the characteristics of cancer in patients. Currently, scientists hope to create a new cancer model that are derived from fresh patient samples and tagged with details about their clinical past. Our purpose was to create patient-derived breast cancer primary cell lines as new cancer model for drug screening and basic research. Methods: Breast cancer tissues were collected in the Department of Breast Surgery, Affiliated Hospital of Guizhou Medical University. The collection of tumor tissue samples was approved by the Ethics Committee of the Affiliated Hospital of Guizhou Medical University (approval number: 2022 ethics No. 313), and the collection and use of tumor tissues complied with the Declaration of Helsinki. The primary breast cancer cell lines were isolated from the patient's breast cancer tissues and cultured in BCMI medium. After the cells proliferated, the media were replaced with DEME medium. Cell line STR genotyping was done to determine cell‑specific genetic markers and identification. Clone formation assay and transplantation assay were done to analyze the ability of breast cancer primary cell lines to form tumors. Results: We created 6 primary breast cancer cell lines. The 6 primary breast cancer cell lines from the patients were tagged with the definitively clinicopathological features, clinical diagnosis, therapeutic regimens, clinical effectiveness and prognostic outcomes. The STR genotyping assays identified the genetic markers and determined the identities of the 6 primary breast cancer cell lines. Clone formation assays and transplantation assay showed that the proliferative capacities of the patient‑derived primary breast cancer cell lines were significantly greater compared with the conventional breast cancer cell lines. Conclusion: We created a panel of 6 patient-derived primary breast cancer cell lines as new cancer model for drug screening and basic research in breast cancer.
[Key words] Breast cancer primary cell lines; Drug discovery; Basic research; New cancer model
2016年美国国家癌症研究所(National Cancer Institute,NCI)停止使用NCI-60细胞系进行药物筛选,标志着传统癌症细胞系失去药物研发工具和基础研究工具的价值。NCI-60细胞指NCI选定的60种人类肿瘤细胞系,从1990年开始用于药物筛选,到2016年已经用于筛选超过10万种小分子化合物[1]。NCI-60细胞停止用于药物筛选的原因是基于传统细胞模型和动物模型的研究结果没有在临床试验中获得相应的疗效,导致70%临床试验失效[2]。究其原因,是因为传统癌症细胞系在几十年的培养中,由于培养选择和克隆进化导致其遗传性状和肿瘤行为的改变,使得这些肿瘤细胞系的生物学特征不能代表患者的癌症真实特征[1,3]。也就是说,由于控制增殖和转移的蛋白质系统发生根本性改变,导致传统的癌症细胞系在增殖和转移的能力上也发生了根本性的改变。由于遗传学性状和生物学行为的改变,这也提示传统肿瘤细胞系失去了作为癌症基础研究工具的价值。因此,现阶段亟待创立一种来源于患者新鲜癌症组织具有清晰临床背景的新的癌症模型。
现阶段缺乏患者癌症组织来源的用于高通量药物筛选的乳腺癌模型。患者来源肿瘤异种移植(patient-derived tumor xenograft,PDX)模型,是将患者的肿瘤组织植入免疫缺陷小鼠体内形成移植瘤模型。这种模型短期在病理学、分子生物学和基因水平重演肿瘤的特征。不过,PDX模型无法用于长期的肿瘤分子生物学机制研究和耐药性研究。本质上,PDX模型无法长期传代保持肿瘤遗传学特征和生物学行为。从技术上和经济层面考虑,PDX模型也无法进行多达万种以上的小分子化合物筛选[4]。同样,从技术上和经济效益考虑,患者来源的类器官模型(patient-derived organoid,PDO)也无法用于多达万种以上的小分子化合物筛选[5]。
我们建立的来源于患者乳腺癌组织的乳腺癌原代细胞系,具有清晰的临床病理学特征,了解具体的治疗方案和治疗效果,也清楚这些乳腺癌患者的预后,可以在体外无限传代,在通用的高糖DMEM培养基中培养,为乳腺癌药物研发和基础研究提供了新模型。
1 材料和方法
1.1 材料
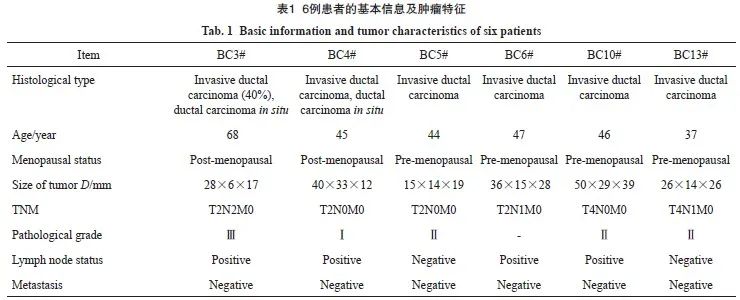
乳腺癌原代细胞培养、鉴定和体内体外增殖实验于2019年8月—2024年2月在贵州医科大学附属医院临床医学研究中心实验室完成。新鲜乳腺癌标本来自于诊断性穿刺活检组织、手术切除组织以及新辅助化疗后手术切除的残余肿瘤组织,其患者临床资料见表1。将取得的乳腺肿瘤组织暂存于含有500 U/mL青霉素和500 mg/mL链霉素的D-Hank’s平衡盐溶液中。肿瘤组织样本收集得到贵州医科大学附属医院伦理委员会批准(伦理编号:2022伦理第313号),患者知情同意并签署知情同意书,在贵州医科大学附属医院乳腺外科收集。所有肿瘤组织收集与使用都遵守赫尔辛基宣言并符合人体组织法。
1.2 试剂
实验动物为SPF级6周龄雌性BALB/c裸小鼠,体重在16~20 g,采购自北京维通利华实验动物技术有限公司,动物实验伦理审查编号:1900733。
DMEM培养基、500 U/mL青霉素、500 mg/mL链霉素、胎牛血清、0.05%胰酶消化液[含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)]购自美国Gibco公司,二甲基亚砜(dimethyl sulfoxide,DMSO)、Triton X-100、 NaCl干粉、KCl干粉、Na2HPO4·12H2O干粉、KH2PO4干粉、NaHCO3干粉和结晶紫染色液购自美国Sigma公司,兔抗人雌激素受体(estrogen receptor,ER)α单克隆抗体、兔抗人孕激素受体(progesterone receptor,PR)A/B单克隆抗体和兔抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)/ErbB2单克隆抗体和山羊抗兔IgG-FC抗体购自美国Cell Signaling公司,一抗稀释液、二抗稀释液购自上海碧云天生物技术股份有限公司,4%的多聚甲醛购自北京索莱宝科技有限公司,抗荧光淬灭封片剂购自北京普利来基因技术公司。
CO2细胞培养箱购自日本Sanyo公司,细胞超净工作台购自苏州净化设备有限公司,TS-8 型转移脱色摇床购自江苏其林贝尔仪器制造有限公司,-20 ℃冰箱购自海尔集团股份有限公司,-80 ℃冰箱购自美国Thermo Fisher公司,恒温电热水浴箱购自北京永光明医疗仪器有限公司,高压蒸汽灭菌器购自日本Hirayama公司,电热鼓风干燥箱购自上海博迅实业有限公司,CM-230标准型纯水仪购自成都艾柯水处理设备有限公司,pH计购自美国Denver公司,微量移液器购自美国Thermo Fisher 公司,低温高速离心机购自美国Beckman公司,AF100制冰机购自意大利Stotsman公司,Elll40型电子天平购自美国Ohaus公司,磁力搅拌器购自德国IKA公司。
1.3 实验方法
1.3.1 分离培养乳腺癌原代细胞
将乳腺癌组织置于含有500 U/mL青霉素和 500 mg/mL链霉素的D-Hank’s平衡盐溶液中,低温转运至实验室4 ℃冰箱储存。无菌的D-Hank’s平衡盐溶液(每次约3 mL)洗涤新鲜肿瘤组织标本2次,然后使用手术剪把肿瘤组织完全剪碎,加入含有140 U/mL的Ⅱ型胶原酶的D-Hank’s平衡盐溶液,放置于37 ℃摇床上以100 r/min的速度大约消化1 h。将肿瘤细胞悬液以1 000 r/min的速度进行离心10 min,弃上清液后培养在BCMI培养基,放置于37 ℃、CO2体积分数为5%的培养箱中。待细胞增殖后,更换为高糖的DMEM培养基。
1.3.2 H-E染色
石蜡包埋乳腺癌组织取自贵州医科大学附属医院病理科,由贵州医科大学附属医院病理科医师确诊为乳腺癌,并确认分子分型。制备好的石蜡切片脱蜡复水后,H-E染色,脱水封片;显微镜镜检,图像采集分析。
1.3.3 免疫组织化学及荧光原位杂交(fluo-rescence in situ hybridization,FISH)检测
乳腺癌免疫組化检测和FISH检测均在贵州医科大学附属医院病理科完成。免疫组织化学检测抗体ER、PR和HER2的试剂盒购自瑞士Roche公司,雄激素受体(androgen receptor,AR)、CK5/6和Ki-67增殖指数的试剂盒购自北京中杉金桥生物技术有限公司,TOP-Ⅱ购自广州安必平医药科技股份有限公司,实验完全按照说明书流程操作,HER2基因检测试剂盒购自美国雅培公司,实验完全按照说明书流程操作。
1.3.4 STR检测
乳腺癌原代培养细胞送至武汉大学中国典型培养物保藏中心进行STR检测。出具STR检测结果。
1.3.5 克隆形成实验
将处于对数生长期的乳腺癌原代培养细胞以200细胞/孔种植在6孔培养板中,每组含有3个同样的样本,放置在37 ℃、CO2体积分数为5%的细胞培养箱中。每3天更换1次培养基。培养10 d后,D-Hank’s平衡盐溶液洗涤2次,加入4%的多聚甲醛溶液固定15 min,用0.1%的结晶紫染液染色15 min,拍照。
1.3.6 动物实验
5 000个BC4#乳腺癌原代细胞和基质胶按照1∶2的比例接种于4只6周龄雌性裸鼠的乳腺脂肪垫上。每隔3天对裸鼠的成瘤情况进行观察,42 d后麻醉致死。手术切除肿瘤。
2 结 果
2.1 乳腺癌原代细胞分离培养及鉴定
从乳腺外科收集乳腺癌组织,经过消化分离后,培养在BCMI培养基约2个月,细胞增殖速度加快,更换成DMEM培养基。我们成功建立了6种可以无限传代的乳腺癌原代细胞系。其中,无限传代是指冻存了至少40支细胞,最多传代20代。本研究团队将乳腺癌组织消化后培养在BCMI培养基中,待乳腺癌细胞增殖后,培养在含有10%血清的DMEM培养基中,但细胞未进行任何永生化处理。本研究发现,增殖速度快的BC4#、BC5#、BC6#和BC13#乳腺癌原代细胞系结合非常分散,而增殖速度慢的乳腺癌原代细胞系BC3#和BC10#结合比较紧密(图1)。
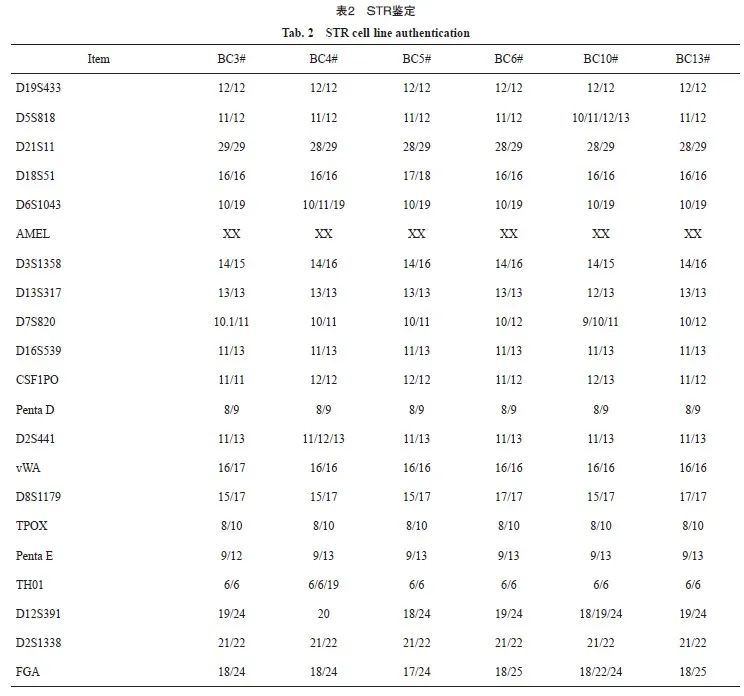
我们在武汉大学中国典型培养物保藏中心对6株乳腺癌原代细胞进行STR鉴定。结果显示,6株细胞均为无交叉污染的人源细胞系,与美国典型培养物保藏中心(American Type Culture Collection,ATCC)的细胞数据进行比对,其特征与当前任何数据都不完全匹配,可以认为本次送检的6株乳腺癌原代细胞是全新的细胞系(表2)。
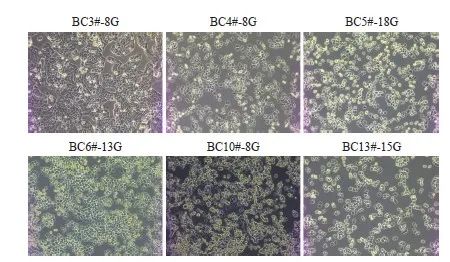
图1 6例乳腺癌患者来源的原代细胞形态(×100)
Fig.1 Morphology of primary cells derived from 6 breast cancer patients (×100)
2.2 患者肿瘤组织H-E染色和乳腺癌标志分子表达
石蜡包埋乳腺癌组织切片经过H-E染色,病理学检查证实这6种乳腺癌原代细胞系来源的乳腺癌均为浸润性导管癌(图2)。石蜡包埋乳腺癌组织切片经过7种分子检测,确定BC3#、BC4#、BC5#、BC10#和BC13#为Luminl A型乳腺癌(表3)。进一步对BC5#、BC6#和BC13#乳腺癌原代细胞HER2基因进行FISH检测后,发现腺癌原代细胞系BC6#为Luminl B型乳腺癌。
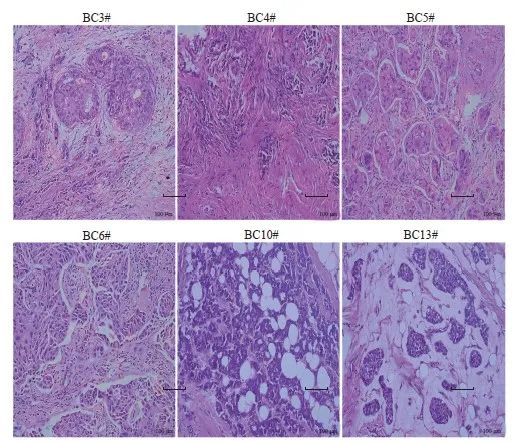
图2 乳腺癌患者肿瘤组织的H-E染色(×200)
Fig. 2 H-E staining of tumor tissues from breast cancer patients (×200)
2.3 细胞增殖能力检测
2.3.1 克隆形成实验
200细胞/ 孔种植在6 孔培养板中,连续10 d培养后,经过ImageJ软件分析,发现平均形成克隆的比例是BC3# ∶ BC4#∶ BC5#∶ BC6#∶ BC10#∶ BC13#∶ MCF-7∶T47D=22∶109∶173∶166∶20∶5∶4。这样显著的克隆能力差异提示乳腺癌原代细胞系BC4#和BC5#具有更强的成瘤能力(图3),提示乳腺癌原代细胞系在增殖能力方面保持了体内肿瘤的真实情况;而传统乳腺癌细胞系长期培养后,增殖能力及与增殖有关的蛋白质系统发生了主要改变[6-7]。
2.3.2 动物实验
5 000个BC4#-5G乳腺癌原代细胞种植在4只雌性裸鼠42 d后,发现在4个裸鼠乳腺脂肪垫有3个形成肿瘤(图4)。我们进一步推断,更低数量的BC4#乳腺癌原代细胞,如500个细胞或者50个细胞移植后可能形成肿瘤。考虑到传统的乳腺癌细胞系,如MCF-7或者MDA-MB-231需要100万个细胞才能形成肿瘤,说明乳腺癌原代细胞系在形成肿瘤能力方面保持了体内肿瘤的真实情况;而传统乳腺癌细胞系长期培养后,形成肿瘤能力及与形成肿瘤能力有关的蛋白质系统发生了主要改变。
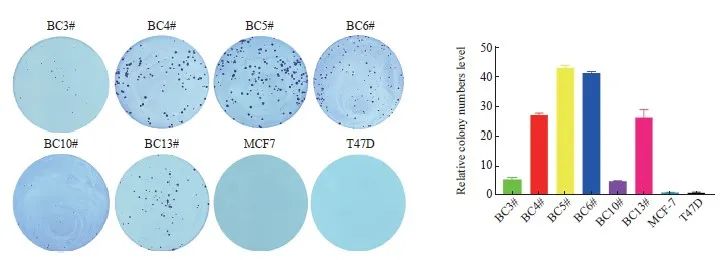
图3 6种乳腺癌原代细胞的克隆形成实验
Fig. 3 Clone expansion assay of 6 primary breast cancer cells
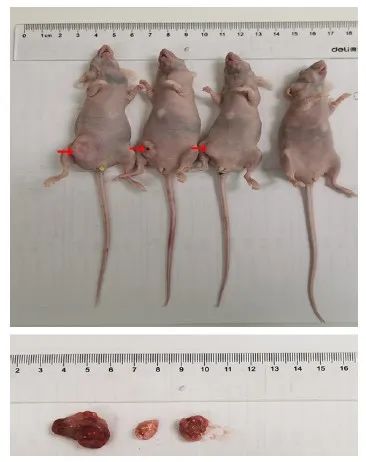
图4 原代乳腺癌细胞BC4#-5G在裸鼠乳腺脂肪垫形成肿瘤
Fig. 4 Tumorigenesis of Primary breast cancer cell BC4#-5G in mammary fat pads of nude mice
#: Indicated tumor from the patient; G: Indicated cell generation.
2.4 乳腺癌患者的基本信息和临床治疗情况
6例患者临床治疗采用新辅助化疗和术后辅助化疗,用药使用EC→T方案,发现患者肿瘤体积缩小,癌组织极少,甚至乳腺组织中未见癌组织(表4)。

3 讨 论
我们从患者来源的乳腺癌组织成功地培养出了可以无限传代的乳腺癌原代细胞系。乳腺癌原代细胞系的后续培养基为广泛使用的DMEM培养基。乳腺癌原代细胞系具有清晰的临床背景,可以为药物研发提供丰富的癌症类型。我们的体外和体内实验说明乳腺癌原代细胞系形成肿瘤的能力比传统的乳腺细胞系强。因此,我们创立的乳腺癌原代细胞系可能为药物研发和基础研究提供新的模型。
现阶段创立可以无限传代的乳腺癌原代细胞系仍是乳腺癌研究的瓶颈问题。有研究[9-10]报道,在建立乳腺癌原代细胞系的过程中,遇到下列问题:① 乳腺癌原代细胞系总成功率是15%。如此低的成功率,使得该项目很难应用于临床药物敏感试验。② 培养基中加入表皮生长因子、胰岛素、霍乱毒素、腺嘌呤和Rho相关蛋白激酶(Rho-associated protein kinase,ROCK)抑制剂等。这些外源的生长因子使得癌症细胞产生抗性。另外,其他的外源因子使得培养价格昂贵,不适合用于临床检测。③ 使用经过放射线照射处理的成纤维细胞作为饲养层细胞。饲养层细胞的缺陷在于:混合的癌症细胞和饲养层细胞很难用于药物敏感性检测,受到辐射的成纤维细胞分泌的生长因子导致癌细胞产生耐药性。④ 研究者使用多种培养基培养癌症细胞,说明没有建立成熟的培养体系。上述结果说明现阶段还没有从患者乳腺癌组织建立可以无限传代乳腺癌原代细胞系的能力。
本研究建立了6种临床背景清晰的乳腺癌原代细胞系。本研究从患者乳腺癌组织培养乳腺癌原代细胞,从18例乳腺癌组织中成功地培养出14例乳腺癌原代细胞系,成功率为77%[11]。尽管开始使用BCMI培养基培养乳腺癌原代细胞,我们培养成功后改为普遍使用的DMEM培养基培养乳腺癌原代细胞,使得这些细胞系可以被其他研究者使用。本研究报道的6种乳腺癌原代细胞系,具有固定的细胞形态,鉴定乳腺癌原代细胞系STR具有特异性的遗传标志。这些乳腺癌原代细胞系具有清晰的临床病理学特征及病理学标志性分子表达,也了解治疗过程和患者预后,为研究这些乳腺癌原代细胞系提供了帮助。BC4#乳腺癌原代细胞裸鼠皮下荷瘤实验发现5 000个甚至更少的乳腺癌原代细胞就可以形成肿瘤,而传统的乳腺癌细胞系则需要100万个细胞才能形成肿瘤,说明我们培养的乳腺癌原代细胞系与传统的乳腺癌细胞系在形成肿瘤能力方面存在显著差异[8]。
综上所述,本研究解决了乳腺癌药物研发和基础研究中的难题,构建了6种具有清晰临床背景的乳腺癌原代细胞系。这些乳腺癌原代细胞系具有清晰的临床病理学特征,特异的病理学标志分子,具体的治疗过程,临床治疗方案,效果和预后,特异的遗传标志,为药物研发和基础研究提供了新工具。我们将继续构建乳腺癌原代细胞系,为乳腺癌药物研发和基础研究提供更加丰富的乳腺癌异质性模型。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
郝弦、罗钰蓓、谭福云、王大红:文献检索、研究设计、实验操作、数据分析及文章撰写;黄建军、王荣、李青、刘晋廷、郑羽、高玉炜:临床组织标本取材、临床资料的收集;杨文秀、张军红、冯江龙、薄莉:病理指导;李静、赵春华、豆晓伟:指导稿件撰写及修改。
[参考文献]
[1]LEDFORD H. US cancer institute to overhaul tumour cell lines[J]. Nature, 2016, 530(7591): 391.
[2]WORKMAN P. The NCI-60 human tumor cell line screen: a catalyst for progressive evolution of models for discovery and development of cancer drugs[J]. Cancer Res, 2023, 83(19): 3170-3173.
[3]CAPES-DAVIS A, BAIROCH A, BARRETT T, et al. Cell lines as biological models: practical steps for more reliable research[J]. Chem Res Toxicol, 2019, 32(9): 1733-1736.
[4]GUILLEN K P, FUJITA M, BUTTERFIELD A J, et al. A human breast cancer-derived xenograft and organoid platform for drug discovery and precision oncology[J]. Nat Cancer, 2022, 3(2): 232-250.
[5]CORSINI N S, KNOBLICH J A. Human organoids: new strategies and methods for analyzing human development and disease[J]. Cell, 2022, 185(15): 2756-2769.
[6]GILLET J P, CALCAGNO A M, VARMA S, et al. Redefining the relevance of established cancer cell lines to the study of mechanisms of clinical anti-cancer drug resistance[J]. Proc Natl Acad Sci U S A, 2011, 108(46): 18708-18713.
[7]GILLET J P, VARMA S, GOTTESMAN M M. The clinical relevance of cancer cell lines[J]. JNCI J Natl Cancer Inst, 2013, 105(7): 452-458.
[8]DOU X W, LIANG Y K, LIN H Y, et al. Notch3 maintains luminal phenotype and suppresses tumorigenesis and metastasis of breast cancer via trans-activating estrogen receptor-Α[J]. Theranostics, 2017, 7(16): 4041-4056.
[9]KODACK D P, FARAGO A F, DASTUR A, et al. Primary patient-derived cancer cells and their potential for personalized cancer patient care[J]. Cell Rep, 2017, 21(11): 3298-3309.
[10]CRYSTAL A S, SHAW A T, SEQUIST L V, et al. Patient-derived models of acquired resistance can identify effective drug combinations for cancer[J]. Science, 2014, 346(6216): 1480-1486.
[11]MOU Y J, HUANG J J, YANG W X, et al. Patient-derived primary breast cancer cells and their potential for predicting sensitivity to chemotherapy[J]. Front Oncol, 2022, 12: 1023391.


