首个LNP-mRNA体内遗传性血管性水肿(HAE)的基因编辑治疗,终身只需一次治疗!
时间:2024-06-04 11:00:36 热度:37.1℃ 作者:网络
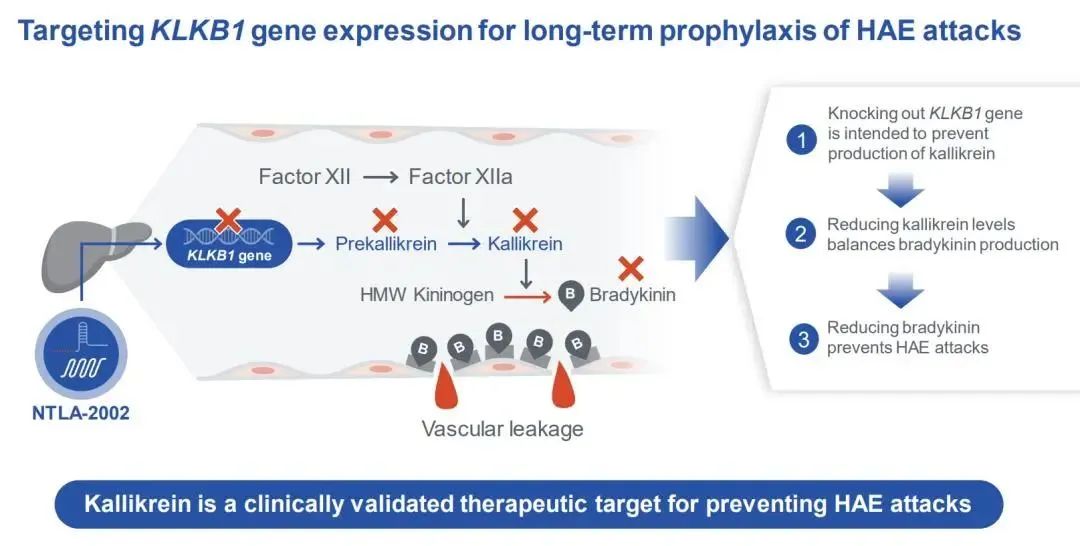
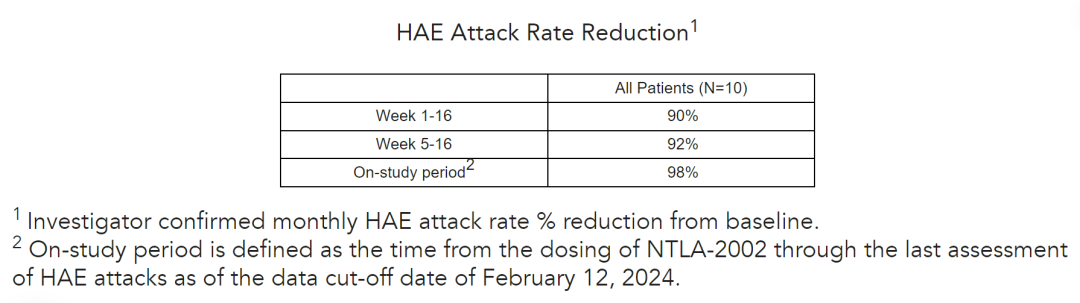
2024年6月2日,由CRISPR基因编辑技术奠基人、诺奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的基因编辑治疗公司Intellia Therapeutics,公布了正在进行的治疗罕见遗传疾病遗传性血管性水肿(HAE)的LNP-mRNA体内基因编辑疗法NTLA-2002 1/2期研究1期阶段的长期随访数据。结果表明,在最早接受治疗的患者中,超过两年的随访数据进一步强化了NTLA-2002作为遗传性血管性水肿(HAE)功能性治愈方案的潜力。10名患者中有8名在16周主要观察期结束后的最新随访中仍完全没有发作,包括那些症状最严重的患者。单次NTLA-2002剂量使月度HAE发作率平均减少了98%,所有患者的平均随访时间超过20个月。100%停用预防性治疗的患者在接受NTLA-2002后仍不需要长期预防性治疗。在所有剂量水平下观察到良好的安全性和耐受性。 詹妮弗·杜德娜(Jennifer Doudna) 本次长期随访数据显示,NTLA-2002有可能成为第一个治疗遗传性血管性水肿(HAE)的一次性治疗方法,达成“一次治疗,终身治愈”的目标。 NTLA-2002 NTLA-2002是一种体内CRISPR基因编辑候选疗法,通过脂质纳米颗粒(LNP)以mRNA形式递送CRISPR-Cas9基因编辑系统,靶向敲除KLKB1基因,以永久性抑制激肽释放酶(kallikrein)的产生,进而抑制缓激肽(bradykinin)的产生,而缓激肽的过度产生会导致遗传性血管性水肿(HAE)的发作。 2023年3月2日,Intellia Therapeutics宣布,FDA批准了NTLA-2002的新药临床试验研究(IND)申请。这也是首个获得FDA批准用于人体临床试验的LNP递送的体内CRISPR基因编辑疗法。 临床试验数据 NTLA-2002是Intellia公司开发的第二款体内CRISPR基因编辑疗法,旨在评估NTLA-2002在I型或II型遗传性血管性水肿(HAE)成人患者中的安全性、耐受性、药代动力学和药效学,包括测定治疗后血浆中激肽释放酶活性水平以及HAE发作率。其中1期临床试验为开放标签、单剂量递增设计,用于确定NTLA-2002的不同剂量水平,2期临床试验将进行随机、安慰剂对照的进一步评估。 2022年11月12日,Intellia公布了NTLA-2002疗法在治疗遗传性血管水肿(HAE)的1/2期临床试验的中期数据。 这些临床数据来自接受 NTLA-2002 疗法的10名不同剂量的遗传性血管水肿(HAE)成年患者,结果显示,所有不同剂量(25mg、50mg、75mg)治疗的患者的致病性的激肽释放酶均显著下降,分别在第32周、第22天、第16周时下降64%、81%、92%。 此外,这些数据还显示,患者在接受单次治疗后遗传性血管水肿(HAE)的发作频率显著下降,25mg和75mg剂量组在治疗后第1周到第16周,发作频率平均分别下降了91%和78%(当时50mg剂量组尚未达到第16周的观察时间)。在所有剂量组中,NTLA-2002 的耐受性普遍良好,大多数不良事件是轻微的。这些临床数据显示了NTLA-2002具有一次治疗、持续缓解的潜力。 最近针对所有治疗患者的长期随访数据显示,在单剂量NTLA-2002后观察到每月发作率平均降低98%,中度至重度发作平均减少99%。中位随访时间为20.1个月,在测试的每个剂量水平下,都实现了稳健、持久的HAE发作率降低水平。个体患者输注后最长的无发作间隔超过26个月,且此间隔时长还在持续增加中。此外,在具有最严重HAE症状的患者中,HAE的发作继续保持减少。在研究开始时,月度HAE发作率最高的两名患者(每月分别为16.8次和14.0次)在16周的主要观察期结束时没有发作,并且在最近的随访中仍然没有发作。这两名患者中最长的无发作持续时间为23.5个月,并且还在继续。此外,在NTLA-2002后停止预防性治疗的患者中,100%仍然不需要长期预防性治疗。 10例患者中有8例在16周的初步观察期后没有发作。这些患者经历了超过18个月的持续无发作持续时间。在两名发作的患者中,一名患者有不需要治疗的轻度发作,一名患者经历了中度发作。在这两名患者中,通过最近的随访,单剂量NTLA-2002后,他们的每月HAE发作率平均降低了97%。 NTLA-2002的给药导致血浆激肽释放酶的剂量依赖性、稳健和持久的减少。从基线到最新评估,血浆激肽释放酶水平的平均降低分别为60%(25mg,88周)、88%(50mg,72周)和95%(75mg,88周)。 在所有三个剂量水平下,NTLA-2002耐受性良好,大多数不良事件的严重程度为轻度。与先前报告的结果一致,最常见的不良事件是输液相关反应和疲劳,大多为1级,并在两天内消退。迄今为止,没有观察到剂量限制性毒性,没有严重的不良事件,也没有观察到3级或更高级别的不良事件。在任何患者中均未观察到有临床意义的实验室异常。在完成1期研究后,接受NTLA-2002治疗的患者将继续参加后续研究,以监测药物的长期安全性和有效性。 Intellia已完成随机、安慰剂对照的2期研究的25毫克和50毫克剂量的入组,并计划在年中报告2期研究主要结果,详细结果预计将在年底的医学会议上公布。公司计划在2024年下半年启动NTLA-2002的关键性3期试验,具体取决于监管反馈。如果一切顺利,公司计划在2026年将该疗法提交美国食品药品监督管理局(FDA)审批。 遗传性血管性水肿(HAE) 遗传性血管性水肿(HAE)是一种罕见遗传性疾病,大约50000人中有1人患病。其特征是身体各个器官和组织中出现严重、反复和不可预测的炎症发作,让患者倍感痛苦、衰弱,甚至危及生命。目前的治疗选择通常是终身治疗,需要每周两次慢性静脉内给药或皮下注射给药,或每天口服给药。但即使长期用药,仍会发生突破性发作。而抑制激肽释放酶(kallikrein)是一种经过临床验证的预防遗传性血管性水肿(HAE)的策略。