JCI Insight:赵强团队分析不同分化阶段转录图谱,揭示诱导神母细胞瘤分化节点分子
时间:2023-12-10 23:39:36 热度:37.1℃ 作者:网络
神经母细胞瘤(NB)是起源于原始神经嵴细胞的胚胎性恶性肿瘤,是5岁以下儿童最常见的颅外实体肿瘤,占小儿恶性肿瘤的8~10%,占儿童恶性肿瘤死亡率的15%,被称为儿童肿瘤之王。高危神经母细胞瘤即使使用手术、化疗、放疗等综合高强度的治疗,其预后仍较差。因此目前亟待提出更加有效的治疗方案,以改善高危神经母细胞瘤患儿的预后。
NB因其来源于原始神经嵴细胞,是一种外周神经系统肿瘤,主要是因神经干细胞分化为神经节细胞和施万细胞(Schwann cells)的过程出现障碍,产生了其他未成熟的神经母细胞、节细胞性神经母细胞,从而导致NB的发生。全基因组测序研究显示儿童肿瘤区别于成人肿瘤,具有较低的外显子突变频率和较少的高频突变基因,同时越来越多的研究表明,表观遗传调控因子的改变是NB的重要驱动因素。因此,研究非翻译区域的表达和功能,是目前NB诊断及治疗领域迫切需要的,也具有深远价值的。
近日,由天津医科大学肿瘤医院 赵强教授 团队发表于 JCI Insight 题为 N6-methyladenosine–mediated overexpression of long noncoding RNA ADAMTS9-AS2 triggers neuroblastoma differentiation via regulating LIN28B/let-7/MYCN signaling 的文章, 本研究通过不同分化阶段NB的转录图谱,分析神经母细胞分化的路径,找寻诱导神经母细胞瘤从“干细胞”表型向“肾上腺能”表型分化的节点分子。通过比较不同分化程度的NB临床标本的转录图谱,研究人员筛选出促进分化成熟的节点lncRNA ADAMTS9-AS2,揭示了ADAMTS9-AS2和LIN28B之间的相互作用抑制了LIN28B与let-7前体之间的相互作用,然后将let-7前体从细胞核中释放到细胞质中形成成熟的let-7,导致癌基因MYCN的表达受到抑制,随后影响肿瘤的干性和分化。此外,研究发现高危组NB中ADAMTS9-AS2的缺失是由于其缺乏N6-甲基腺苷修饰导致的。总之,本研究表明ADAMTS9-AS2的缺失可促进肿瘤转移、肿瘤干性并诱导NB分化功能障碍。

本研究中以 NB 的分化障碍为切入点,通过比较节细胞神经瘤、低危组节细胞神经母细胞瘤、高危组神经母细胞瘤的转录图谱,找出促进分化的候选节点lncRNA,筛选出特异性lncRNA ADAMTS9-AS2。通过R2数据库及临床样本验证了ADAMTS9-AS2的表达与诱导NB的分化成熟密不可分,提升ADAMTS9-AS2是一个特异性的分化节点lncRNA。
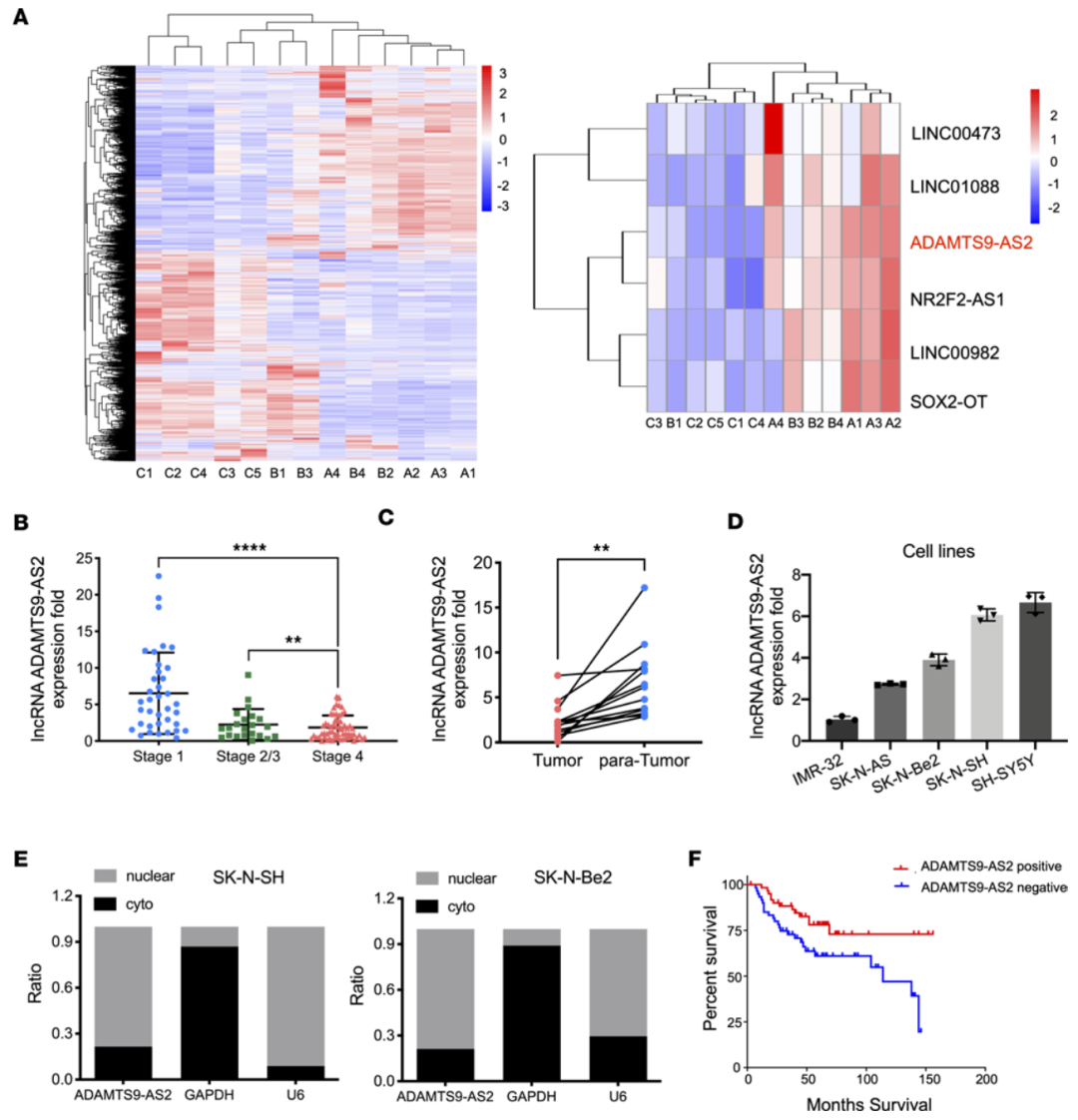
在NB中ADAMTS9-AS2是一个特异性的分化节点lncRNA,该图总结了A:RNA-seq测序热图。B:神经母细胞瘤中ADAMTS9-AS2的差异表达与INSS分期相关。C:癌及对应癌旁中ADAMTS9-AS2的差异表达。D:ADAMTS9-AS2在NB细胞系中的表达。E:ADAMTS9-AS2在NB细胞中细胞核和质的分布情况。F:K-M生存曲线分析。
应用质谱技术探索与ADAMTS9-AS2相互作用的蛋白,再经过RNA-pulldown实验验证了ADAMTS9-AS2与LIN28B存在相互作用。LIN28B是一个同源的高保守的RNA结合蛋白,定位于6q21染色体。LIN28B能与LIN28A共同作用将人类成纤维细胞重新编码成多潜能干细胞,其在细胞分化、代谢和肿瘤的发生发展中起到了重要的作用;LIN28B是let-7的生物合成抑制剂,它在神经母细胞瘤中过表达并调控MYCN和肿瘤干性相关基因。并且在神经母细胞瘤细胞系中ADAMTS9-AS2的表达会明显抑制MYCN的表达。
本研究明确了LIN28B是与ADAMTS9-AS2相互作用的关键蛋白,并显示ADAMTS9-AS2和LIN28B之间的结合抑制了LIN28B和let-7前体之间的相互作用,导致let-7前体释放到细胞质中形成成熟的let-7,随后抑制了MYCN的活性。同时,ADAMTS9-AS2通过直接与NB中的LIN28B结合,抑制了LIN28B/let-7/MYCN介导的肿瘤干性和转移功能。
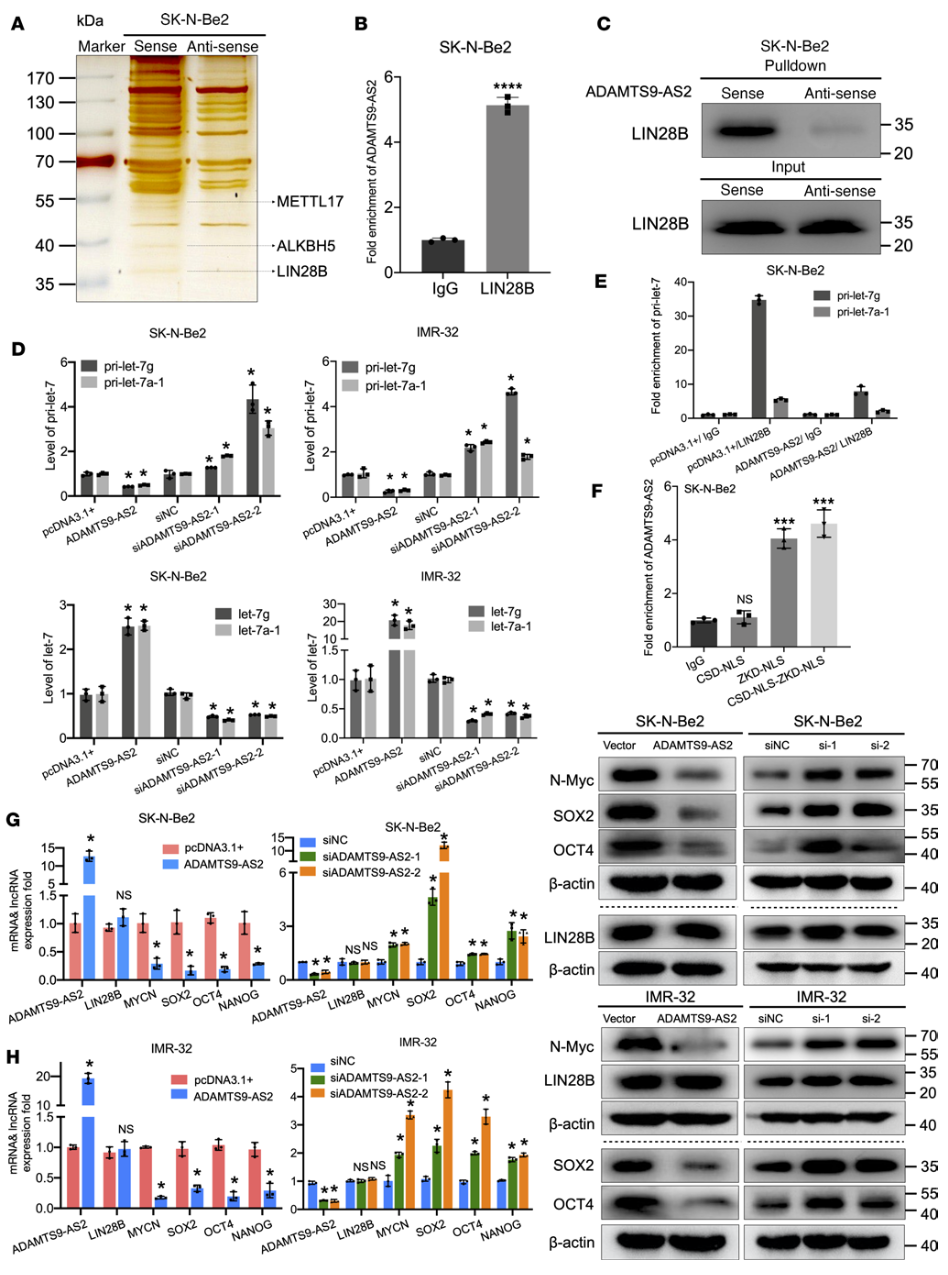
ADAMTS9-AS2通过与LIN28B直接相互作用而抑制let-7前体与LIN28B的相互作用,该图总结了A:pulldown实验结合质谱检测探索ADAMTS9-AS2相互作用蛋白。B:RIP实验。C:RNA pulldown实验。D:qRT-PCR分析ADAMTS9-AS2的表达对let-7前体(pri-let-7)和let-7成熟体表达的影响。E:RIP实验。F:RIP试验验证ADAMTS9-AS2与构建的的CSD-NLS、ZKD-NLS结构域和CSD-NLS-ZKD-NLS结构域的结合。G&H:ADAMTS9-AS2的表达对LIN28B、MYCN、SOX2、OCT4和NANOG表达的影响。
M6A(N6-methyladenosine,6-甲基腺嘌呤)甲基化修饰在RNA转录后调控发挥重要的作用,特别是在m6A甲基化修饰促进lncRNA结果稳定性及表达水平发生改变中起重要功能。本研究发现甲基转移酶METTL3和去甲基化酶ALKBH5在NB中与ADAMTS9-AS2的结合,而且m6A修饰与ADAMTS9-AS2的差异性表达有关。在NB细胞系中METTL3和ALKBH5的表达量,与ADAMTS9-AS2的表达量趋势一致。结果表明,NB中m6A修饰促进 ADAMTS9-AS2表达的稳定性,进而抑制了MYCN的表达。
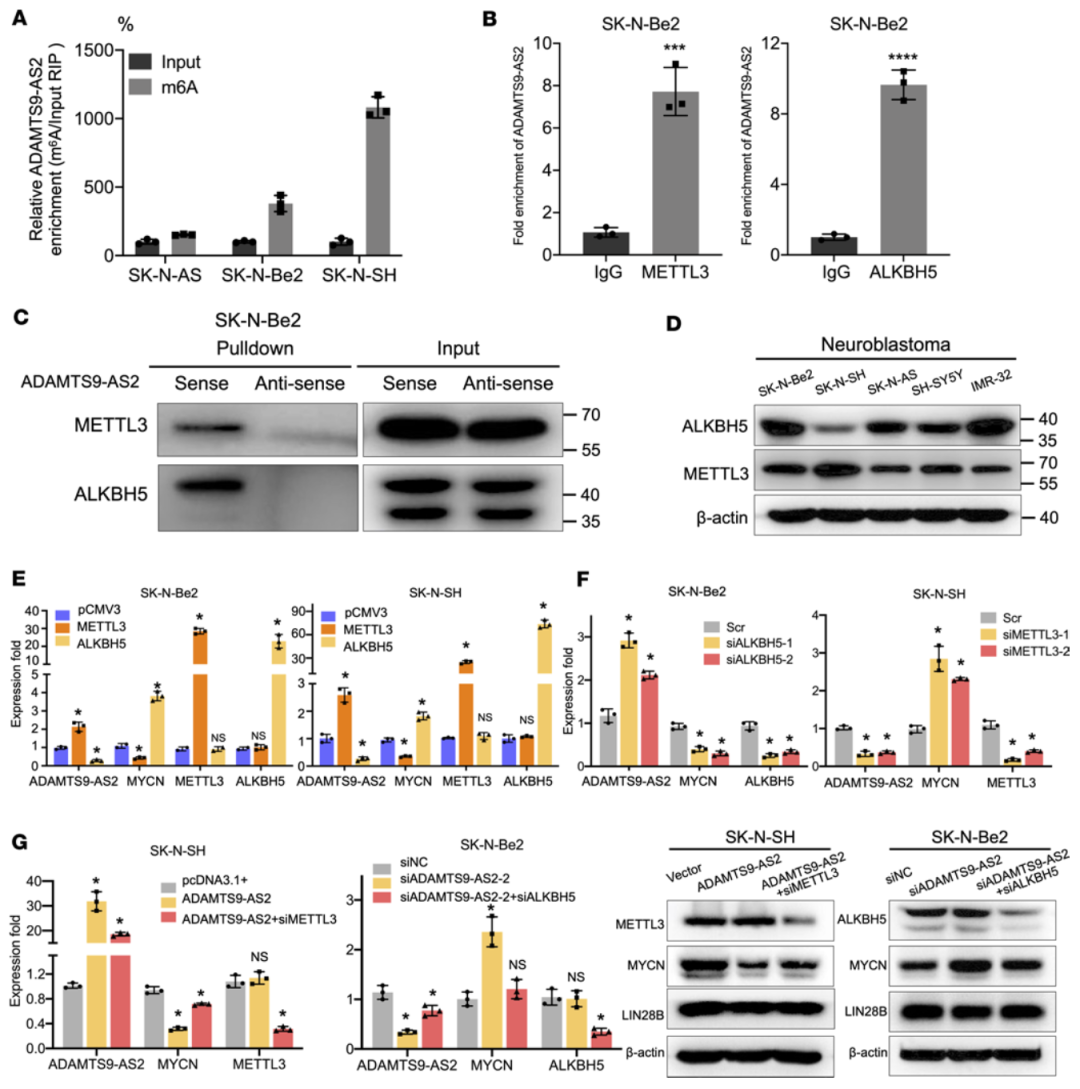
NB细胞中ADAMTS9-AS2的表达水平受m6A修饰的调节,该图总结了A:ADAMTS9-AS2与METTL3或ALKBH5的RIP实验。B:RNA-pulldown实验。C:NB细胞中M6A-RIP。D:NB细胞系中ALKBH5和METTL3的表达差异。E&F:在高表达或降表达METTL3或ALKBH5的NB中评估ADAMTS9-AS2及MYCN的表达水平。G: qRT-PCR和Western blot实验。
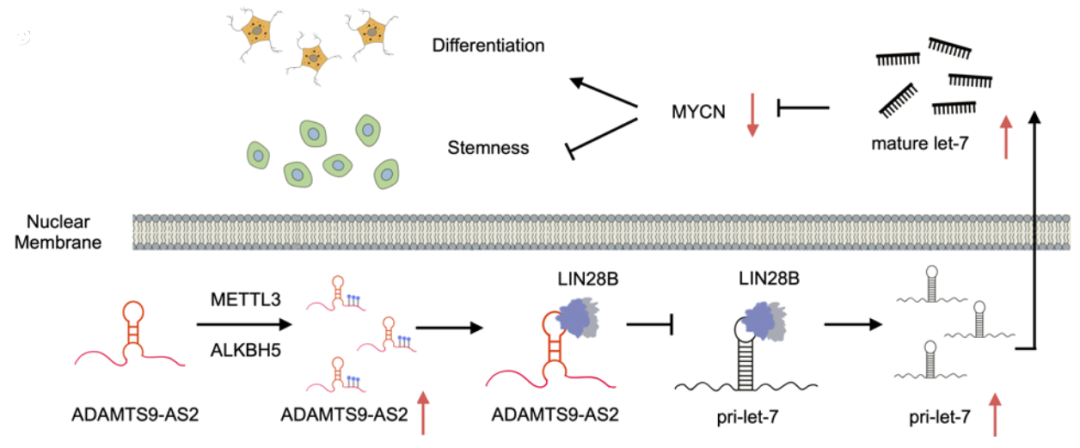
ADAMTS9-AS2在LIN28B/let-7/MYCN轴中的功能及其在抑制肿瘤干性和诱导NB分化的作用。
总之,该研究为探索NB分化成熟的新机制提供了重要的思路。来源于神经嵴的交感肾上腺细胞的分化障碍是NB的主要起因。本研究以NB的分化障碍为切入点,聚焦lncRNA ADAMTS9-AS2诱导NB分化的新功能,明确分化节点lncRNA ADAMTS9-AS2作为预测NB患者不良预后的独立风险因素的临床前景,研究成果有望为逆转NB分化障碍提供新的理论依据,对提升NB的预后生存具有重要的临床价值和意义。文章中指出ADAMTS9-AS2应用于神经母细胞瘤病理分化、早期诊断和预后的分子标记物的前景,以及可用于临床肿瘤诱导分化治疗的新靶点、新药物和新方法。


