南医大李玲玲/江苏科大郑芬芬Biomaterials: 藻蓝蛋白辅助原位生成硫化铜纳米点实现结直肠癌的高效协同治疗
时间:2023-08-11 19:36:05 热度:37.1℃ 作者:网络
结直肠癌 (colorectal cancer,CRC) 是最常见的癌症类型之一,世界范围内发病率和死亡率一直居高不下。手术、化疗和放射治疗是结直肠癌常见的临床治疗方法,但这些方法通常存在一些不可避免的副作用。因此,微创、高效和精确的治疗策略备受期待。值得注意的是,内源性硫化氢的高表达与结直肠癌细胞的增殖转移过程息息相关,那么能否利用这一点对其进行特异性治疗是一个具有意义的探索方向。
光热疗法 (photothermal therapy, PTT) 是一种通过近红外区激光照射使光热剂产生热效应,提高肿瘤局部温度,从而实现消除肿瘤的目的,具有疗效高、可控性好及侵袭性损伤最小等优点。近红外二区 (NIR-Ⅱ, 1000-1350 nm) 激光比近红外一区 (NIR-Ⅰ, 750-1000 nm) 具有更深的组织穿透能力,逐渐成为PTT的首选。遗憾的是,大多数光热剂“always-on”的PTT性质不可避免地导致沿光路到肿瘤部位的正常组织损伤。此外,高温高压合成的光热剂的潜在毒性危害和缓慢的清除效应,使其应用潜力也受到很大限制。近年来,一种理想的替代策略是利用前体在细胞内合成纳米颗粒,以响应肿瘤相关的刺激,称为原位生成策略。另一方面,蛋白质与金属离子和气体分子的相互作用优势,逐渐在蛋白质纳米系统中凸显出来。藻蓝蛋白 (phycocyanin,PC) 作为一种从藻类植物中提取的天然蛋白,能够与多种金属离子形成络合,适宜的波长激发下发出红色荧光,在联合治疗中也具有独特的优势。
基于此,来自南京医科大学的李玲玲教授团队和江苏科技大学郑芬芬副教授团队共同提出了一种多功能治疗纳米组件(PZTC/SS/HA),实现肿瘤环境中原位生成硫化铜纳米点,在NIR-Ⅱ激光照射下实现了特异性协同治疗CRC。相关工作以“A Tumor Microenvironment-Activatable Nanoplatform with Phycocyanin-Assisted in-situ Nanoagent Generation for Synergistic Treatment of Colorectal Cancer”为题发表在Biomaterials期刊上,论文的第一作者为南京医科大学的博士研究生孙骁潇、硕士研究生梁晓晔以及硕士研究生王钰凯。该工作得到了国家自然科学基金面上项目 (22074066, 21804059) 支持。

【文章要点】
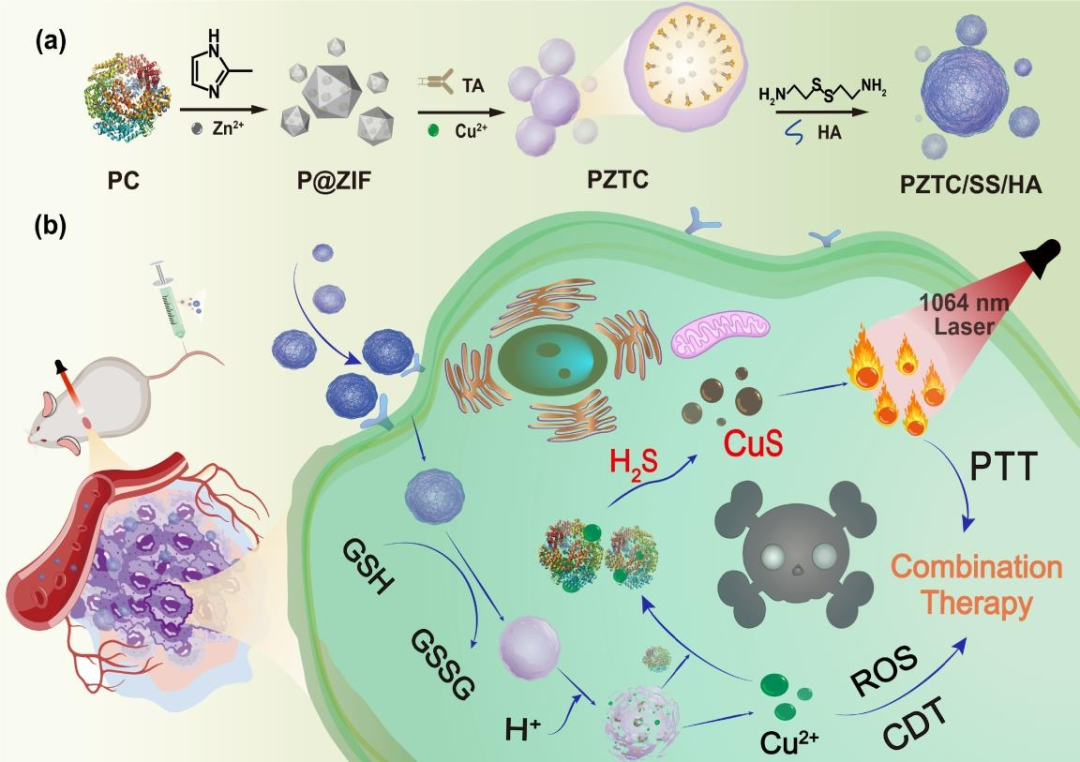
图1 PZTC/SS/HA NCs的构建及联合治疗示意图
在这项研究中,在水相中将藻蓝蛋白装载于ZIF的骨架内,骨架提供了较大的空腔结构以保留蛋白活性,并以此为模板,进一步通过多酚类化合物单宁酸 (tannic acid, TA)与金属铜离子的相互作用,在表面构建了一层金属多酚层Cu2+-TA。并在表面修饰了二硫键保护层及靶向透明质酸 (hyaluronic acid, HA) 层。制备得到纳米胶囊的大小在150 nm左右,通过各种表征手段确证了高铜含量的复合载体的成功构建 (图2)。
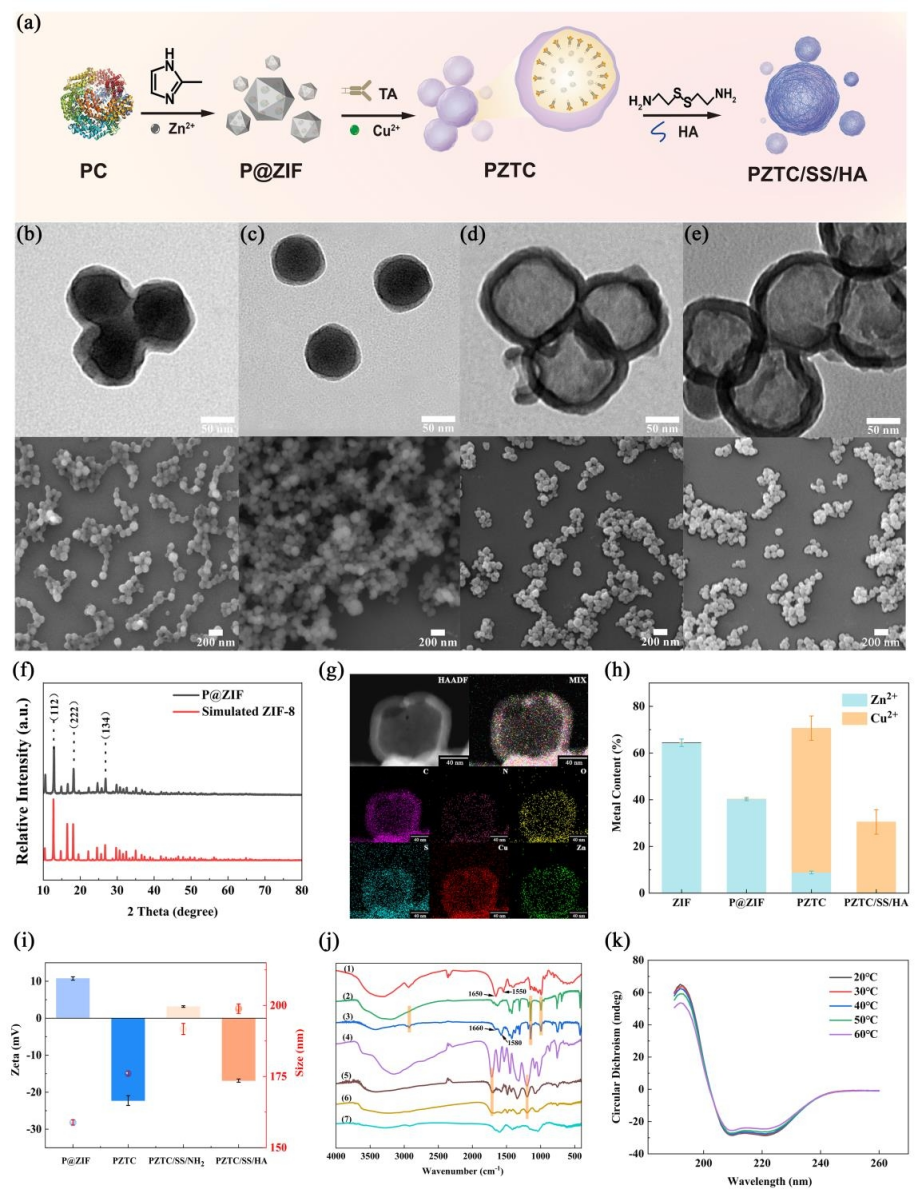
图2 PZTC/SS/HA NCs的表征
该载体依靠表面HA靶向识别进入肿瘤微环境 (tumor microenvironment, TME) 后,由于GSH的存在,二硫键保护层很快被损耗,而微酸TME环境下氢离子的竞争导致多酚金属层的快速破裂,释放出藻蓝蛋白及Cu2+ (图3)。酸性条件下,游离的Cu2+可通过类芬顿反应产生ROS,并且随着温度升高,化学动力学 (chemodynamic therapy, CDT) 效应被增强。与此同时,PC蛋白具有铜离子高亲和性,可以作为铜离子富集器提升肿瘤部位局部铜离子浓度,并结合高表达的内源性硫化氢,实现在TME中高效原位生成硫化铜 (CuS) 纳米点的目的。这种纳米点在NIR-Ⅱ激光照射下有优良的光热性能,光热转换效率高达61.6%。
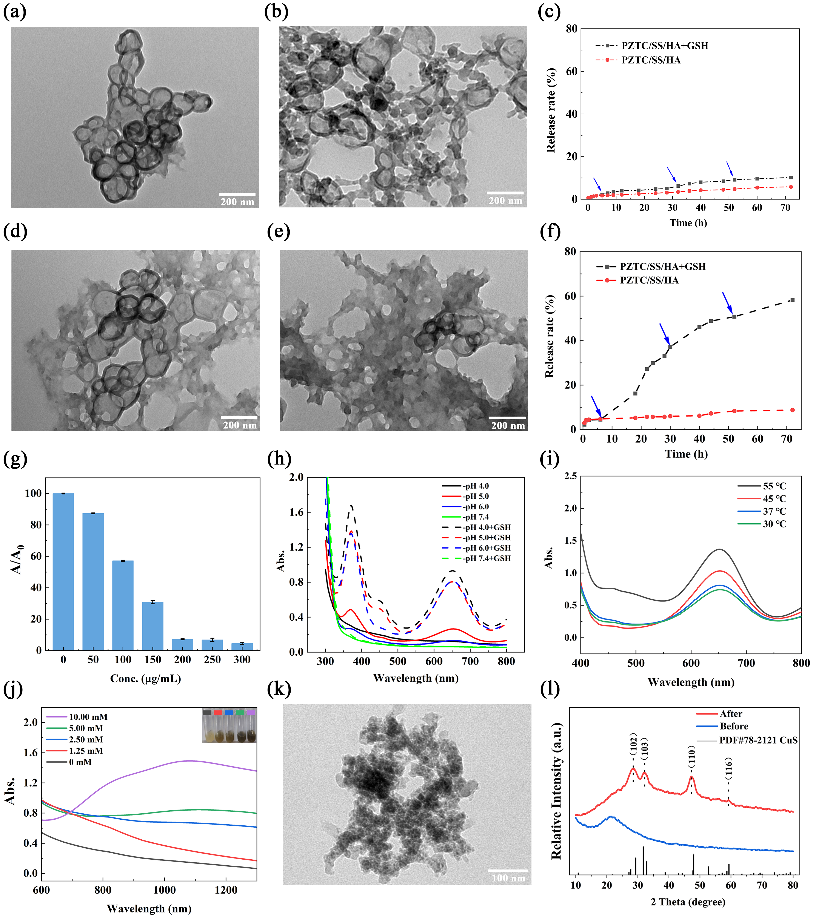
图3 PZTC/SS/HA NCs在TME中的降解及CuS的生成
体外实验结果表明 (图4),PZTC/SS/HA通过HA与肿瘤细胞表面高表达的CD44受体的靶向结合,优先在肿瘤区域聚集。PZTC/SS/HA NCS对正常细胞毒性小,而作用于HCT-116细胞时,其存活率显著下降,在激光(1064 nm)干预后有更低的存活率,表明对肿瘤细胞具有显著的细胞毒性作用,并且能够使用激光作为开关来控制PTT,提高肿瘤治疗的效率。此外,PZTC/SS/HA NCS持续消耗H2S和GSH,达到改善肿瘤微环境的效果。PZTC/SS/HA NCS+Laser组的ROS水平显著增加,说明存在TME激活的PTT-CDT协同作用。
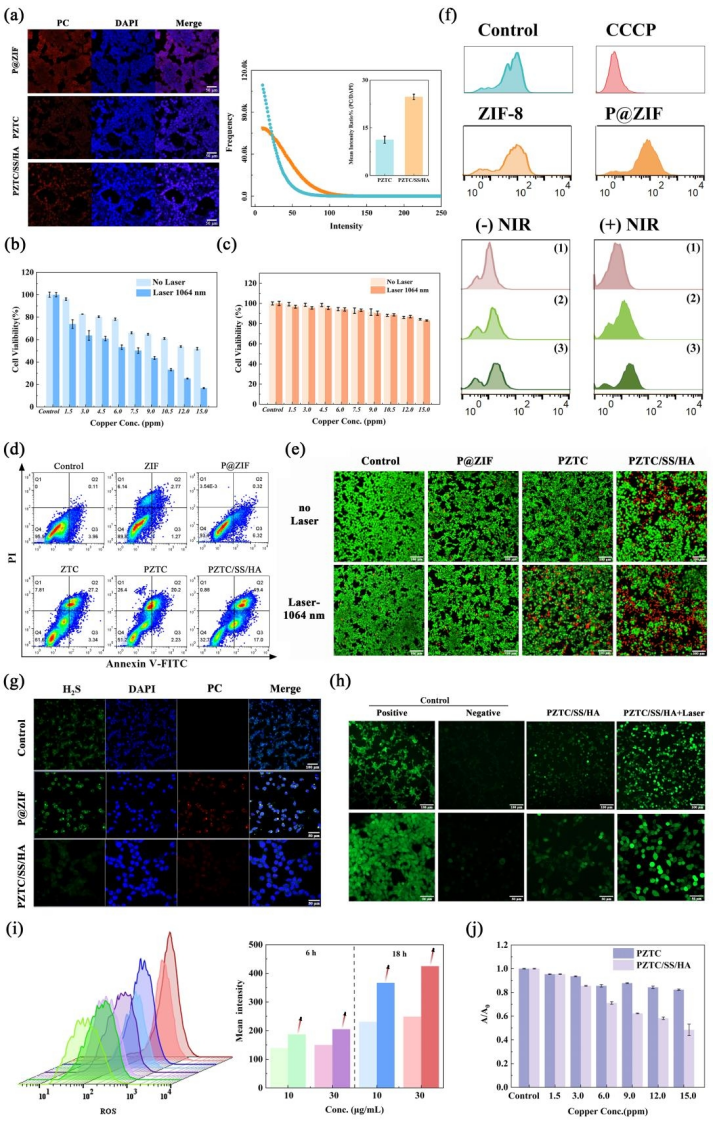
图4 PZTC/SS/HA NCs 体外实验结果
值得一提的是,以蛋白质为模板形成金属硫化物纳米颗粒是载体制备和合成中的一种常见策略,但这一策略很少应用于光热剂在细胞内的原位合成。在这个体系中,PC能以较大的空间结构和丰富的官能团捕获Cu2+,有利于提高细胞内局部Cu2+浓度并促进CuS的形成。通过间接法证明了PC和Cu2+之间的动态相互作用。
PZTC/SS/HA纳米复合材料具有良好的生物相容性。PZTC/SS/HA NCS+Laser组对HCT-116荷瘤小鼠的肿瘤生长有显著的抑制作用,抑制率为95%。且PZTC/SS/HA NCS+Laser组的肿瘤组织凋亡明显升高,而对其余器官(心、肝、脾、肺和肾)未出现明显的组织损伤,说明了其肿瘤特异性及治疗安全性 (图5)。另外,初步的免疫组化结果显示,加入PC后,PZTC/SS/HA组肿瘤的CD8+和CD4+ T细胞增多,这可能与提高的PTT/CDT效率以及PC的免疫增强作用有关。
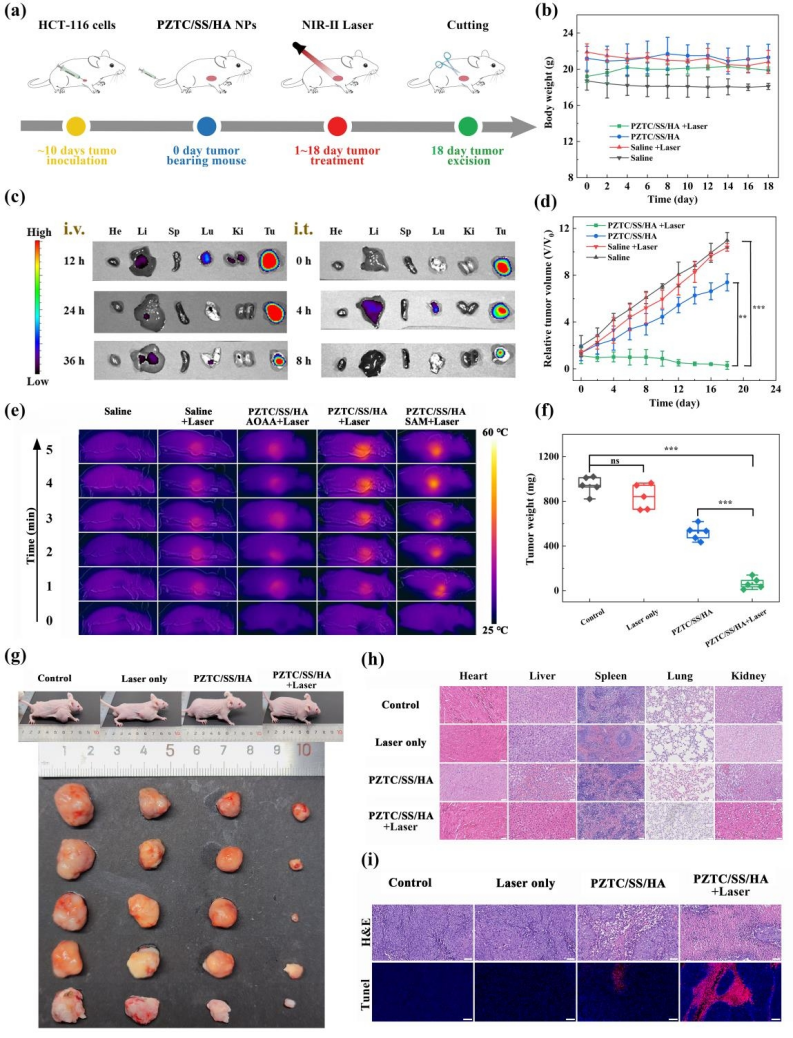
图5 PZTC/SS/HA NCs对HCT-116荷瘤小鼠模型的体内肿瘤治疗评估
【结论与展望】
综上所述,该团队设计了一种智能靶向CRC的纳米治疗体系PZTC/SS/HA,实现了原位生成CuS的PTT-CDT协同治疗。这种利用CRC中特异的硫化氢的高表达以及TME激活的策略在体内外都显示出优良的治疗效果,将PC用于辅助原位生成CuS光热剂是一种有意义的尝试,为生物分子辅助原位纳米药物的产生和有效的TME响应协同治疗CRC开辟了新的途径。
原文链接:
https://doi.org/10.1016/j.biomaterials.2023.122263


